Die genaue Pathogenese eines Delir ist nach wie vor unklar. Meist wirken mehrere Faktoren zusammen. Auslöser kann ein Ungleichgewicht der Neurotransmitter des zentralen Nervensystems sein. Neue Modelle greifen die „Brain-Network-Theory“ auf. Die Autoren stellen die wichtigsten Theorien und Botenstoffe vor, die für die Signalübertragung in den Gehirnnetzwerken zuständig sind, und erklären, wie es zu Störungen in Aufmerksamkeit, Wachsamkeit, kognitiven Funktionen, emotionaler Regulation und motorischer Kontrolle kommt.
Ein Delir ist ein Syndrom, das gemäß den Kriterien der fünften Auflage des von der American Psychiatric Association herausgegebenen Klassifikationssystems für psychische Störungen (DSM-V-Kriterien) das Zusammenspiel einer akuten und fluktuierenden Aufmerksamkeitsstörung in Kombination mit einer Bewusstseinsstörung und/oder Störung der Kognition beschreibt.
Ein Delir ist demnach keine eigenständige Erkrankung. Dem Syndrom liegt dabei die pathobio- logische Störung einer akuten Enzephalopathie zugrunde [1], Letztere könnte im EEG [2] sichtbar gemacht werden [3]. Die DSM-V-Kriterien beschreiben klinische Merkmale, welche einer persönlichen Einschätzung von Befunden bedürfen und mit einer körperlichen und neurokognitiven Untersuchung einhergehen.
Ein Delir wird durch eine Kombination verschiedener prädisponierender (zum Beispiel hohes Alter, vorbestehende kognitive Defizite, Multimorbidität) und präzipitierender (auslösender) Faktoren (zum Beispiel Operationen, Infektionen, Elektrolytstörungen) verursacht. Die meisten Ursachen haben ihren Ursprung außerhalb des Gehirns und sind dennoch das Ergebnis einer komplexen Interaktion vieler Faktoren, die zu einer Dysregulation im Gehirn führen [4, 5].
Delir – ja, nein, vielleicht
Ein Delir ist ein akuter und sich in kurzer Zeit (Stunden bis Tage) entwickelnder, fluktuierender, klinischer Zustand einer Aufmerksamkeitsstörung in Kombination mit einer Bewusstseins- und/oder Kognitionsstörung. Die Dauer ist variabel; die meisten Episoden dauern wenige Tage. Bei bis zu 20 Prozent der Betroffenen können Episoden über Wochen oder Monate andauern. Der Begriff „subsyndromales Delir“ beschreibt Zustände, die einige Merkmale eines Delirs aufweisen, aber nicht alle DSM-V-Kriterien erfüllen [3, 6].
Die langfristigen, manchmal auch milden kognitiven Einschränkungen, die nach einem Intensivaufenthalt auftreten können, sind vom Delir ebenso wie von einer Demenz abzugrenzen. Neurokognitive Defizite können nach Operationen, großen Eingriffen und Sepsis auftreten und werden unterteilt in solche, die bis zu 30 Tage anhalten (Delayed Neurocognitive Recovery), und solche, die länger andauern (Neurocognitive Disorders, NCD) [7].
Früher gab es für diese Zustände die Bezeichnungen „Postoperative Cognitive Decline“ (POCD) oder „Longterm Cognitive Decline“ (LTCD) [8]. Im Gegensatz zum Delir zeigen diese Einschränkungen oft keine Aufmerksamkeitsstörungen.
Neurotransmitterhypothese. Unser Gehirn ist durch neuronale Netzwerke strukturiert, in denen Neuronen häufig durch gegenseitige Hemmung verbunden sind. Da die meisten Nervenzellen nur einen Transmitter verwenden, lassen sich bestimmte Transmitter einzelnen neuronalen Netzwerken zuordnen. Neurotransmitter sind chemische Botenstoffe, die an der Übertragung von Signalen zwischen Nervenzellen beteiligt sind.
Sie lösen je nach Art des Signals entweder erregende (EPSP) oder hemmende (IPSP) postsynaptische Potenziale aus. Wichtige Neurotransmitter im Zentralnervensystem (ZNS) sind Glutamat, GABA, Glycin, Acetylcholin, Serotonin, Dopamin und Histamin.
Die Kenntnis der Rolle dieser Neurotransmitter in der Hirnfunktion und ihre Dysregulation sind von entscheidender Bedeutung für das Verständnis der Pathophysiologie eines Delirs, einer akuten Enzephalopathie und anderen kognitiven Störungen.
Acetylcholin (ACh) ist besonders bedeutend für die synaptische Übertragung im Gehirn. Ein Mangel an ACh ist mit verminderter Wachheit und Aufmerksamkeitsdefiziten verbunden, wie sie bei der Alzheimer-Demenz auftreten können. Die Hemmung der Cholinesterase, eines Enzyms, das ACh abbaut, wird klinisch genutzt, um den ACh-Spiegel zu erhöhen und die Alzheimer-Erkrankung zu behandeln. Jedoch konnte für Cholinesterase-Inhibitoren keine Delirreduktion gezeigt werden [9, 10].
Serotonin (5-HT) moduliert Erregungen im ZNS und beeinflusst den Kreislauf sowie die Schmerzverarbeitung. Ein Ungleichgewicht von Serotonin kann von Stimmungsstörungen bis hin zum serotonergen Syndrom führen. Im Kreislauf ist es an der Regulierung des Vasomotorentonus beteiligt. Im ZNS dämpft 5-HT Erregungen und verursacht das Gefühl einer Beruhigung und Zufriedenheit – ein Überschuss führt zur Antriebslosigkeit. Viele Psychopharmaka, unter anderem für Antidepressiva, setzen an diesen Rezeptoren an, zudem werden 5-HT3-Rezeptor-Antagonisten als Antiemetika eingesetzt.
Dopamin, das „Belohnungshormon“. Ein Mangel ist charakteristisch für die Parkinson-Krankheit und kann mit kognitiven Defiziten einhergehen. Dopaminrezeptor-Agonisten werden zur Behandlung eingesetzt, können aber auch psychotische Symptome verursachen, wohingegen Dopamin-Antagonisten die Symptome verschlimmern können.
Histamin reguliert Schlaf und Aufmerksamkeit im Gehirn und beeinflusst die kortikale Erregbarkeit. Ein Überschuss an Histamin kann zu Schlafstörungen führen, hingegen verursacht eine Blockade histaminerger Rezeptoren Schläfrigkeit. Neben den Neurotransmittern gibt es noch einige weitere Substanzen, deren Kenntnis bei der Pathogenese eines Delirs zu beachten sind, zum Beispiel Glukokortikoide und Melatonin.
Glukokortikoide, die aus der Nebennierenrinde stammen, dienen primär dazu, Energie in akuten Situationen bereitzustellen und nicht vitale Funktionen zu hemmen. Die Wirkung des Glukokortikoids Kortisol erfolgt über verschiedene Mechanismen, darunter spezifische Rezeptoren, Second-Messenger-Systeme und direkte genomische Effekte. Bei chronischem Stress, wie er auf Intensivstationen auftreten kann, führt eine chronische Stimulation sogenannter Low-Affinity-Kortikoid-Rezeptoren zu Schädigungen des ZNS. Der Hippocampus, der eine hohe Dichte an Kortikoid-Rezeptoren aufweist und zentrale Gedächtnisfunktionen steuert, ist besonders anfällig für exzessive Kortikoidspiegel. Diese können sich frühzeitig zu Störungen des Kurzzeitgedächtnisses manifestieren und in einem Delir resultieren. Auch Schmerz kann über die adrenerge Stressantwort und die systemische Entzündungsreaktion ein Delir hervorrufen und unterhalten.
Melatonin wird im Hypothalamus in der Epiphyse (Corpus pineale) produziert und reguliert den Tag-Nacht-Rhythmus durch seine zirkadiane Rhythmik. Eine helle Umgebung hemmt die Produktion. Hohe Melatoninspiegel sind nicht nur mit Müdigkeit verbunden, sondern zeigen auch zellprotektive und antikortikoide Effekte. Melatonin kann durch proinflammatorische Zytokine gehemmt werden, was den Tag-Nacht-Rhythmus stören kann und mit einer erhöhten Delirinzidenz assoziiert ist. Studien zu postoperativen Patienten mit Hüftgelenksfrakturen zeigten unterschiedliche Ergebnisse bezüglich der Auswirkungen von Melatonin auf die Delirinzidenz [11], wobei höhere Melatoninspiegel mit einem hypoaktiven Delir und niedrigere mit einem hyperaktiven Delir korrelieren könnten. Es gilt also auch hier: Melatonin ist ein Medikament mit einer notwendigen individuellen Indikationsstellung.
Bedeutung der Neuroinflammation. Neben den beschriebenen Neurotransmitterveränderungen ist gesichert, dass systemische Entzündungsreaktionen – sei es durch Infektion oder Trauma – zur Aktivierung des Immunsystems führen die eine entscheidende Rolle bei der Entstehung des Delirs spielen kann. Hierbei stehen besonders Interleukin-1 β, Interleukin-6 und Tumornekrosefaktor-α im Fokus. Diese gelangen aus dem peripheren Blutkreislauf in das ZNS und interagieren mit Mikroglia (eine Gruppe von Immuneffektorzellen des ZNS).
Etwa 15 Prozent der Gliazellen im Gehirn sind Mikroglia, die Funktionen ähnlich wie Gewebsmakrophagen ausführen. Die Freisetzung dieser proinflammatorischen Zytokine führt zu spezifischen Effekten in neuronalen Netzwerken, die Verhaltensänderungen hervorrufen können, die klinisch als ein Delir erscheinen. Im Alter kann diese Störung der Homöostase aufgrund chronischer Inflammation zu einer verstärkten Reaktion auf Inflammationsreize führen („Aberrant Stress Response“) [12]. Mit zunehmendem Alter kommt es zu degenerativen Veränderungen der Gefäße im Gehirn, was die zerebrale Durchblutung einschränkt, den Transport von Plasmaproteinen stört und die Durchlässigkeit der Blut-Hirn-Schranke verringert. Dies erhöht die Anfälligkeit des Gehirns für proinflammatorische Zytokine, die aus dem peripheren Blutkreislauf eindringen können.
Mikroglia, bereits durch Alterungsprozesse „geprimt“, neigt dazu, auch auf geringe proinflammatorische Reize mit einer übermäßigen Zytokinausschüttung zu reagieren. Dies wäre eine Erklärung dafür, warum ältere Menschen ein erhöhtes Delirrisiko haben und warum selbst eine moderate Entzündung zu einem schwerwiegenden und persistenten Delir führen kann. Die Kenntnis präoperativer kognitiver Einschränkungen ist besonders wichtig, da Alter und kognitive Leistungsfähigkeit unabhängig voneinander Risikofaktoren für ein Delir darstellen [13, 14].
Cholinesterase. In den zurückliegenden Jahren wurde versucht, spezifische Laborparameter zu identifizieren, die charakteristisch für das Delir sind. Besonderes Interesse galt dabei den Cholinesterasen (ChE), zu denen vor allem die Plasmacholinesterase (BuChE) und die Acetylcholinesterase (AChE) gehören. AChE findet sich hauptsächlich auf Zellmembranen von Erythrozyten sowie in muskulären Endplatten und Synapsen, hingegen wird BuChE von der Leber produziert, und ins Plasma sezerniert. Während inflammatorischer Prozesse ist die Aktivität der ChE akut reduziert und niedrigere BuChE-Aktivität wurde mit erhöhter Mortalität nach Trauma und Sepsis in Verbindung gebracht. ChE-Inhibitoren, wie Rivastigmin, zeigen günstige Effekte auf kognitive Fähigkeiten bei Demenz, jedoch ließ sich deren Wirksamkeit zur Delirprophylaxe nicht bestätigen. Studien mussten wegen eines Trends zu erhöhter Mortalität frühzeitig abgebrochen werden.
Störung der Gehirnnetzwerke – die „Brain-Network-Theory“
Arbeiten verschiedene spezialisierte Gehirnregionen zusammen, um eine bestimmte Funktion auszuführen, sprechen wir von einem Gehirnnetzwerk. Ein bekanntes Beispiel ist das Default Mode Network, ein Zusammenschluss mehrerer Gehirnregionen, die in Ruhe aktiv sind und mit Selbstreflexion und Zukunftsplanung beschäftigt sind. Der Grad, zu dem die Aktivität in einer bestimmten Gehirnregion zeitlich mit der Aktivität in anderen Regionen des Netzwerks übereinstimmt, gilt als funktionale Konnektivität. Solche Zeitbeziehungen lassen sich unter anderem im EEG und in der funktionellen Magnetresonanztomografie untersuchen.
Gehirnnetzwerke bestehen aus Knoten (Nodes) und den Verbindungen zwischen diesen Knoten, den sogenannten Kanten (Edges). Knoten, die eine Schlüsselrolle im Netzwerk spielen, werden als Hubs bezeichnet. Die Definition eines Hubs kann auf verschiedene Weisen erfolgen, etwa durch die Bestimmung, wie oft ein Knoten auf den kürzesten Wegen zwischen anderen Knoten vorkommt (Zentralität). Hubs spielen eine wichtige Rolle im Netzwerk, da hier Informationen aus verschiedenen Gehirnregionen zusammenlaufen.
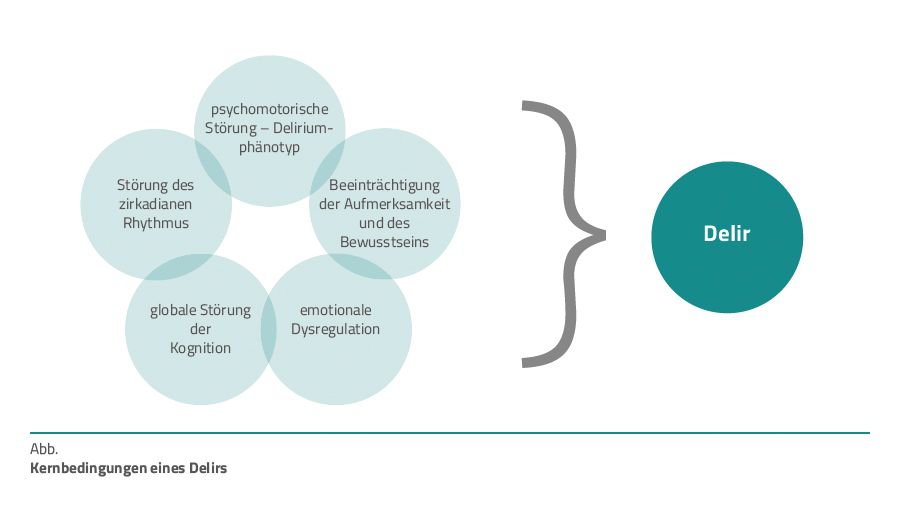
Ein Delir ist sehr heterogen und die klinischen Symptome neigen dazu, selbst beim gleichen Patienten und am selben Tag zu schwanken. Die Ätiologie und Pathophysiologie sind komplex und nur teilweise verstanden. Wichtige – wie die beschriebenen – Faktoren beeinflussen kritisch die Gehirnnetzwerke. Dies führt klinisch zu Störungen in Aufmerksamkeit, Wachsamkeit, kognitiven Funktionen, emotionaler Regulation und motorischer Kontrolle. Patienten mit einem postoperativen hypoaktiven Delirium zeigten eine geringere zentrale Rolle der Hubs im Alpha-Frequenzband des EEG im Vergleich zu Patienten mit ähnlichen klinischen Symptomen, jedoch mit einer anderen zugrunde liegenden Ursache, wie dem Aufwachen nach einer Narkose.
Das EEG kann beim Delir eine verringerte Konnektivität und einen Verlust des normalen posterior-anterior gerichteten Informationsflusses zeigen. Alterung und Demenz führen auch zu einer verminderten Netzwerkaktivität. Mit anderen Worten: Wenn das Netzwerk funktioneller Gehirnareale durch Alterung oder andere Faktoren, die die Kommunikationsqualität zwischen diesen Arealen beeinträchtigen, geschwächt ist, können auslösende Faktoren wie Entzündungen und Stress, zum Beispiel infolge großer Operationen, das Gehirnnetzwerk so stören, dass eine Vielzahl von Funktionen betroffen sind. Die Idee, das Delir als Störung der Gehirnnetzwerkfunktion in fünf Dimensionen (Abb. 1) zu verstehen, hilft zu erklären, warum das Syndrom so unterschiedliche klinische Symptome aufweist und warum ein Delir auftreten kann, aber nicht auftreten muss [15].
Delir hat nicht nur einen Auslöser
Eine wesentliche Erkenntnis der vergangenen Dekade ist, dass häufig kein einzelner Faktor als alleiniger Auslöser eines Delir zu identifizieren ist. Während Hypoxie oder Hypoglykämie klare monokausale Auslöser darstellen, die vergleichsweise einfach zu therapieren sind, ist das klinische Bild des Delirs in der Regel komplexer und multifaktoriell. Störungen von Neurotransmittern und proinflammatorischen Zytokinen beeinträchtigen letztlich die Fähigkeit der verschiedenen funktionalen Gehirnregionen, harmonisch zusammenzuarbeiten, was zu einer diffusen Beeinträchtigung der kognitiven Funktionen, Aufmerksamkeitsdefiziten und verändertem Bewusstsein führt.
Von entscheidender Bedeutung ist das Verständnis, dass sowohl prädisponierende Faktoren vorhanden sein müssen als auch ausreichend starke präzipitierende Faktoren, um die Schwelle für die klinische Manifestation eines Delirs zu überschreiten. Nicht jeder prädisponierende Risikofaktor führt zwangsläufig zu einem Delir, wenn nicht auch entsprechende präzipitierende Faktoren vorliegen.
Hinzu kommen die eigenen Coping-Mechanismen des Körpers. Je nachdem wie „fit“ wir gerade sind und wie gut unsere eigene „Energie“ ist, können wir mehr oder minder diese Situationen ausgleichen. Dieses Modell erklärt, warum bestimmte Zustände, die bei jungen und gesunden Patienten keine Symptome verursachen, bei älteren Patienten schwerwiegende Auswirkungen haben können.
Delir
Der vorliegende Artikel ist eine Zusammenfassung aus den Kapiteln „Wie entsteht ein Delir“ und „Wechselbeziehungen von Schmerz, Agitation und Delir“ des Buches „Delir – Prävention, Therapie und Pflege im interprofessionellen Team“. Herausgeber: Carsten Hermes. Dieses Buch beschreibt aus verschiedenen Perspektiven, wie bei Patientinnen und Patienten im Umfeld der Intensiv- und Überwachungsbereiche ein Delir erkannt und behandelt werden kann.
ISBN: 9783437450037, Elsevier, Juli 2023, 312 Seiten
Zu diesem Beitrag steht online eine englischsprachige Fassung als Download-PDF zur Verfügung.
[1] Slooter AJC, Otte WM, Devlin JW et al. Updated nomenclature of delirium and acute encephalopathy: statement of ten Societies. Intensive care medicine 2020; 46 (5): 1020–1022. doi.org/10.1007/s00134-019-05907-4
[2] Hermes C. Renaissance des EEG für Detektion und Monitoring von Delirium und Enzephalopathie. PflegenIntensiv 2021 (2); 18: 60–65
[3] Numan T, Slooter AJC, van der Kooi AW et al. Functional connectivity and network analysis during hypoactive delirium and recovery from anesthesia. Clinical neurophysiology: official journal of the International Federation of Clinical Neurophysiology 2017; 128 (6): 914–924. doi.org/10.1016/j.clinph.2017.02.022
[4] Wilson JE, Mart MF, Cunningham C et al. Delirium. Nature reviews. Disease primers 2020; 6 (1): 90. doi.org/10.1038/s41572-020-00223-4
[5] Ottens TH, Hermes C, Page V et al. The Delphi Delirium Management Algorithms. A practical tool for clinicians, the result of a modified Delphi expert consensus approach. Delirium (Bielefeld, Germany), 2024. doi.org/10.56392/001c.90652
[6] Hermes C, Ottens TH, Knitter P et al. Delir – Beurteilung, Vorbeugung und Behandlung: Aufgabe im interprofessionellen Team der Intensivstation [Delirium-assessment, prevention and treatment: Task in the interprofessional intensive care unit team]. Medizinische Klinik, Intensivmedizin und Notfallmedizin 2022; 117 (6): 479–488. doi.org/10.1007/s00063-022-00943-3
[7] Evered L, Silbert B, Knopman DS et al. Recommendations for the nomenclature of cognitive change associated with anaesthesia and surgery – 2018. British journal of anaesthesia 2018; 121 (5): 1005–1012. doi.org/10.1016/j.bja.2017.11.087
[8] Borchers F, Spies CD, Feinkohl I et al. Methodology of measuring postoperative cognitive dysfunction: a systematic review. British journal of anaesthesia 2021; 126 (6): 1119–1127. doi.org/10.1016/j.bja.2021.01.035
[9] Maldonado JR. Delirium pathophysiology: An updated hypothesis of the etiology of acute brain failure. Int J Geriatr Psychiatry 2018; 33 (11): 1428–1457
[10] van Eijk MM, Roes KC, Honing ML et al. Effect of rivastigmine as an adjunct to usual care with haloperidol on duration of delirium and mortality in critically ill patients: a multicentre, double-blind, placebo-controlled randomised trial. Lancet (London, England) 2010; 376 (9755): 1829–1837. doi.org/10.1016/S0140-6736(10)61855-7
[11] de Jonghe A, van Munster BC, Goslings JC et al. Effect of melatonin on incidence of delirium among patients with hip fracture: a multicentre, double-blind randomized controlled trial. CMAJ : Canadian Medical Association journal = journal de l‘Association medicale canadienne 2014; 186 (14): E547–E556. doi.org/10.1503/cmaj.140495
[12] Cunningham C, Hennessy E. Co-morbidity and systemic inflammation as drivers of cognitive decline: new experimental models adopting a broader paradigm in dementia research. Alzheimer‘s research & therapy 2015; 7 (1): 33. doi.org/10.1186/s13195-015-0117-2
[13] Rudolph JL, Inouye SK, Jones RN et al. Delirium: an independent predictor of functional decline after cardiac surgery. Journal of the American Geriatrics Society 2010; 58 (4): 643–649. doi.org/10.1111/j.1532-5415.2010.02762.x
[14] Guenther U, Hoffmann F, Dewald O et al. Preoperative Cognitive Impairment and Postoperative Delirium Predict Decline in Activities of Daily Living after Cardiac Surgery-A Prospective, Observational Cohort Study. Geriatrics (Basel, Switzerland) 2020; 5 (4): 69. doi.org/10.3390/geriatrics5040069
[15] van der AJ, Ottens TH, Lodema DY et al. Eeg en innovatieve behandeling van verminderde hersenconnectiviteit bij delirium [Electroencephalography and connectivity in delirium]. Tijdschrift voor psychiatrie 2023: 65 (10): 633–636