Die neue S3-Leitlinie „Invasive Beatmung und Einsatz extrakorporaler Verfahren bei akuter respiratorischer Insuffizienz“ gibt evidenzbasierte Empfehlungen zur intensivmedizinischen Atemunterstützung bei schwerem respiratorischen Versagen – mit Fokus auf Nutzen, Risiken und moderne Strategien. Der Beitrag stellt ausgewählte Empfehlungen daraus vor.
Die invasive maschinelle Beatmung ist in der Intensivmedizin eine der am häufigsten eingesetzten therapeutischen Maßnahmen und bei der Versorgung kritisch Erkrankter seit über 50 Jahren zentraler Bestandteil der Versorgung. Zu den führenden Indikationen zählen Bewusstseinsstörungen und Störungen des Gasaustauschs.
Die Beatmung ermöglicht eine lebensrettende Therapie. Zugleich ist jedoch bekannt, dass die Beatmung unabhängig von der Grunderkrankung selbst erhebliche Risiken birgt. Insbesondere wenn lungenschonende Strategien nicht angewendet werden, kann die Beatmung die Lunge schädigen oder sogar zu letalen Komplikationen führen. Um den Nutzen zu maximieren und potenzielle Schäden zu minimieren, ist der evidenzbasierte Einsatz moderner Beatmungsstrategien entscheidend.
Inhalt. Die Leitlinie (Textkasten: Die Leitlinie) verfolgt das Ziel, evidenzbasierte Empfehlungen für die Indikation und Durchführung invasiver Beatmung sowie damit zusammenhängender begleitender Maßnahmen zu geben. Dazu gehören Extrakorporalverfahren bei Patientinnen und Patienten mit schwerer akuter respiratorischer Insuffizienz auf der Basis des derzeitigen Stands der Literatur. Neue Erkenntnisse führten zu einer umfassenden Aktualisierung der Vorgängerversion. Die Leitlinie behandelt Beatmungsverfahren, Monitoringsysteme, Weaning, Sedierung, Delirmanagement und invasive Technologien wie die Extrakorporale Membranoxygenierung (ECMO).
Auf Grundlage neuer Studiendaten und deren Bewertung hat die Leitliniengruppe 28 der ursprünglich 119 Empfehlungen angepasst, 36 Empfehlungen gestrichen oder ersetzt, 46 unverändert übernommen und zusätzlich 22 neue Empfehlungen aufgenommen [1].
Zielgruppe. Die Leitlinie richtet sich an alle Mitglieder des Behandlungsteams auf Intensivstationen, die invasiv beatmete Patienten oder Patienten mit extrakorporalen Lungenunterstützungsverfahren behandeln und betreuen. Die Leitlinie soll Ärztinnen und Ärzten aus den Bereichen Innere Medizin, Anästhesiologie, Chirurgie, HNO, Neurologie, Pädiatrie, Palliativmedizin, Hygiene, Geriatrie sowie Pflegepersonal, Rettungsfachpersonal, Mitarbeitenden der Physiotherapie, Fachpersonal für Kardiotechnik beziehungsweise Beatmungstherapie eine systematische und umfassende Entscheidungshilfe für die tägliche klinische Praxis auf der Intensivstation sein.
Weiterhin wollen die Autorinnen und Autoren mit der Leitlinie den Patienten und deren Angehörigen sowie den Mitgliedern anderer medizinischer Berufsgruppen eine vertrauenswürdige und belastbare Informationsquelle zur rationalen Anwendung invasiver Beatmung und extrakorporaler Verfahren bei akuter respiratorischer Insuffizienz anbieten [1].
Relevanz. Die invasive Beatmung bleibt eine zentrale Maßnahme bei respiratorischem Versagen und zur Atemwegssicherung, ist jedoch mit erheblichen Risiken wie ventilatorinduzierter Lungenschädigung und systemischen Nebenwirkungen verbunden, etwa der Unterhaltung systemischer inflammatorischer Reaktion oder der Reduktion der Perfusion abdomineller Organe. Lungenprotektive Strategien senken nachweislich die Mortalität, werden in der klinischen Praxis aber noch unzureichend umgesetzt. Bei schwerem Lungenversagen gewinnen Verfahren wie ECMO und CO₂-Elimination zunehmend an Bedeutung [1].
Patientenzielgruppe. Die Autoren haben die Leitlinie erstellt für die Behandlung von Patienten mit akuter respiratorischer Insuffizienz jenseits der Neugeborenenperiode, bei denen eine invasive Beatmung erwogen oder bereits durchgeführt wird. Weiterhin gilt die Leitlinie für Patienten, die aufgrund einer schweren respiratorischen Insuffizienz des Einsatzes eines extrakorporalen Verfahrens zur Sicherstellung des Gasaustausches bedürfen.
Die Leitlinie
Im August 2025 wurde unter Federführung der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) die S3-Leitlinie „Invasive Beatmung und Einsatz extrakorporaler Verfahren bei akuter respiratorischer Insuffizienz“ in der Version 2.0 veröffentlicht. Insgesamt waren 19 Fachgesellschaften der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) und acht weitere Fachgesellschaften aller Organisationen beteiligt. Die Langversion der Leitlinie hat einen Umfang von 287 Seiten und steht auf der Website kostenlos als Download zur Verfügung [1]. Dort findet sich auch eine Kurzfassung (Umfang 28 Seiten), die sich im Wesentlichen auf die Auflistung der Empfehlungen beschränkt und somit einen raschen Überblick ermöglicht. Erklärungen und Begründungen finden sich in der Langfassung.
Mit dem Schlusskapitel zur Folgeversorgung und zu Langzeitfolgen wendet sich die Leitlinie auch den bereits genannten Patientengruppen in der Phase nach beendeter invasiver Beatmung oder extrakorporaler Lungenunterstützung zu [1].
Versorgungsbereich. Der Leitlinie zufolge umfasst der Versorgungsbereich [1]
- Patienten auf Intensivtherapiestationen,
- Patienten, die unter Fortführung intensivtherapeutischer Maßnahmen transportiert werden müssen,
- präklinische Notfallpatienten mit akuter respiratorischer Insuffizienz (Polytrauma, Bewusstseinsstörungen, nichtheilbare Erkrankungen).
Leitlinienklassen. Leitlinien der AWMF sind in vier auf die Entwicklungsmethodik bezogene Stufen eingeteilt: S1, S2k, S2e und S3. S3 kennzeichnet den höchsten Evidenzgrad (Tab. 1) [2].
Die Leitlinienautoren haben zunächst nationale und internationale Leitlinien gesichtet und geprüft. Relevante Inhalte daraus haben sie bei Bedarf übernommen. Zur Bewertung der Evidenz nutzten sie in erster Linie aktuelle und qualitativ hochwertige Metaanalysen. Die methodische Qualität einzelner Studien haben sie nach den SIGN-Kriterien (Scottish Intercollegiate Guidelines Network) bewertet, die Gesamteinschätzung erfolgte nach dem GRADE-System (Grading of Recommendations, Assessment, Development and Evaluation), einem standardisierten und transparenten Ansatz für die Bewertung der Vertrauenswürdigkeit der Evidenz und der Stärke von Empfehlungen im Gesundheitswesen.
Sofern keine geeigneten Metaanalysen vorlagen, zogen sie stattdessen randomisierte kontrollierte Studien oder Studien niedrigerer Qualität heran und werteten diese in Evidenztabellen aus. Alle Evidenzprofile und Tabellen sind im Evidenzreport einsehbar. Am Ende wurde die Vertrauenswürdigkeit der Evidenz in einem vereinfachten Profil zusammengefasst – basierend auf den fünf GRADE-Kategorien zur Qualität der Evidenz (Tab. 2).
Empfehlungsgrade. Für jede Empfehlung haben die Autoren auf Basis der vorhandenen Evidenz abgewogen, wie das Verhältnis von Nutzen und möglichen Risiken einer Therapie einzuschätzen ist und wie groß das Vertrauen der Leitliniengruppe in diese Einschätzung ist. Darauf aufbauend kamen die Kriterien des Evidence to Decision Framework (ETDF) zum Einsatz: Nutzen und Schaden, Qualität der Evidenz, Wertvorstellungen, Ressourcenbedarf und -verfügbarkeit, Akzeptanz sowie praktische Umsetzbarkeit [3].
Die Stärke einer Empfehlung hängt daher nicht automatisch von der Qualität der Gesamtevidenz ab, sondern berücksichtigt auch diese zusätzlichen Faktoren (Tab. 3) [1].
Anmerkungen. Aus Sicht des Verfassers ist es bedauerlich, dass in der Leitlinie die englischen Begriffe „mild“ und „moderate“ übernommen wurden, statt sie inhaltlich korrekt zu übersetzen (mild = leicht, moderate = mittel). Dieses Vorgehen ist häufig zu beobachten und führt mitunter zu missverständlichen Formulierungen.
Am Beispiel des Schädel-Hirn-Traumas (SHT) zeigt sich dies deutlich: Im Deutschen würde man nicht von einem „milden“ oder „moderaten“ SHT sprechen. Ebenso wäre es sprachlich klarer, bei akutem Lungenversagen (Acute Respiratory Distress Syndrome, ARDS) von einem „mittelschweren“ statt einem „moderaten“ ARDS zu sprechen.
Ausgewählte Empfehlungen
Nachfolgend finden sich ausgewählte Empfehlungen aus der Leitlinie – mit Fokus auf neue Empfehlungen oder sogenannte Schlüsselempfehlungen. Bei Letzteren handelt es sich um Empfehlungen, von deren Umsetzung sich die Leitliniengruppe einen besonders ausgeprägten Nutzen für oder die Abwendung von Schaden von Patienten mit akuter respiratorischer Insuffizienz erhofft.
Empfehlung 1 (neu):
Wir schlagen vor, Patient:innen mit schwerer akuter hypoxämischer respiratorischer Insuffizienz (PaO2/FiO2 < 100 mmHg) primär invasiv zu beatmen.
• Vertrauenswürdigkeit der Evidenz: (sehr niedrig)
• Empfehlungsgrad: schwach
Die PaO2/FiO2-Ratio (kurz: P/F-Ratio) ist der Oxygenierungsindex nach dem Chirurgen Joel Horovitz, auch Horovitz-Quotient genannt. Bei der Berechnung des Oxygenierungsindex entspricht PaO2 dem arteriellen Sauerstoffpartialdruck in mmHg, weshalb eine arterielle Blutgasanalyse benötigt wird. FiO2 steht für die inspiratorische Sauerstoffkonzentration, wobei für die Berechnung die Dezimalzahl zu verwenden ist, also beispielsweise 0,70 anstelle von 70 Prozent.
Beispiel 1:
- PaO₂ = 69 mmHg
- FiO₂ = 0,70
- PaO₂/FiO₂ (P/F-Ratio) = 69/0,70 = 98,6 mmHg
Dieser Oxygenierungsindex entspricht einer schweren akuten hypoxämischen respiratorischen Insuffizienz (PaO2/FiO2 < 100 mmHg). Der Leitlinie zufolge fehlen bislang prospektiv randomisierte Studien dazu, ob der Beginn einer invasiven Beatmung ab einer bestimmten Schwere der Oxygenierungsstörung positive Effekte auf patientenrelevante Outcomes hat. Allerdings erfordert die Anwendung höherer PEEP-Werte entsprechend der ARDS-Netzwerktabelle laut den Autoren eine invasive Beatmung.
Ein weiteres wichtiges Argument zur Schadensvermeidung aus klinischer Sicht ist nach Einschätzung der Leitliniengruppe, dass bei einer Intubation mit bereits niedriger P/F-Ratio das Risiko für schwere Hypoxämien und damit verbundene hämodynamische Komplikationen deutlich ansteigt. Aufgrund der sehr niedrigen Evidenz basiert die Empfehlung auf einem Expertenkonsens.
PEEP (Positive End-Expiratory Pressure) bedeutet übersetzt „Positiver endexspiratorischer Druck“. PEEP verhindert das vollständige Entweichen der Ausatemluft durch ein Ventil. Dieser am Ende der Ausatmung (endexspiratorisch) in den Atemwegen aufrechterhaltene Druck ist der PEEP-Wert.
Wichtig zu wissen: PEEP kann die Bildung von Atelektasen (kollabierten Lungenabschnitten) verhindern und die rekrutierten Lungenabschnitte vor erneutem Kollaps schützen. PEEP führt zu einer Erhöhung der funktionellen Residualkapazität (FRC). Die FRC ist das Volumen, das nach einer normalen Ausatmung in der Lunge verbleibt. Auf diese Weise wird die Gasaustauschfläche vergrößert.
Empfehlung 2 (neu):
Wir schlagen vor, bei Patient:innen mit milder bis moderater akuter hypoxämischer respiratorischer Insuffizienz (PaO2/FiO2 100–300 mmHg) primär eine nichtinvasive Atmungsunterstützung (NIV, CPAP oder HFNO) anzuwenden.
• Vertrauenswürdigkeit der Evidenz: (moderat)
• Empfehlungsgrad: schwach
Beispiel 2:
- PaO₂ = 120 mmHg
- FiO₂ = 0,60
- PaO₂/FiO₂ (P/F-Ratio) = 120/0,60 = 200 mmHg
Die Berechnung aus Beispiel 2 zeigt ein Ergebnis, das einer leichten bis mittelschweren akuten hypoxämischen respiratorischen Insuffizienz entspricht. Die Anwendung einer nichtinvasiven Atmungsunterstützung bietet den Vorteil der Vermeidung einer Intubation. Der Begriff NIV (nichtinvasive Ventilation) bedeutet maschinelle Atemhilfe ohne Einsatz eines Endotracheal- oder Tracheostomietubus. NIV kann für unterschiedliche Beatmungsmuster stehen.
Druckunterstützung. Die Druckunterstützung ist eine gängige Form der NIV. Bezeichnungen dafür sind beispielsweise PS (Pressure Support), ASB (Assisted Spontaneous Breathing) oder IPS (Inspiratory Pressure Support). Dabei erhält der Patient zum Zeitpunkt seiner spontanen Einatmung eine zusätzliche Atemunterstützung, indem das Gerät durch Verabreichung eines Gasstroms einen voreingestellten Überdruck (inspiratorisches Druckniveau) aufbaut. Die Druckunterstützung entlastet die erschöpfte Atemmuskulatur.
Continuous Positive Airway Pressure (CPAP). Die CPAP ist eine reine Spontanatmung auf einem von der Anwenderin oder dem Anwender vorgegebenen kontinuierlich erhöhten Druckniveau in den Atemwegen. Die Unterstützung des Patienten besteht lediglich in einer kontinuierlichen Erhöhung des Druckniveaus mit den entsprechenden Effekten. Zwar sind CPAP und PEEP nicht exakt das Gleiche, aber vereinfacht gesagt ist CPAP die Anwendung von PEEP (ohne Druckunterstützung) beim spontan atmenden Patienten.
Wichtig zu wissen: Praktisch kommen CPAP und die Druckunterstützung oft gemeinsam zum Einsatz, um die Vorteile zu kombinieren. Dementsprechend heißen diese Formen der NIV beispielsweise CPAP/ASB oder CPAP/PS.
High-Flow Nasal Oxygen (HFNO). Bei dieser Form der nichtinvasiven Atemunterstützung, die auch unter HFNC (High-Flow Nasal Cannula) zu finden ist, erhält der Patient erwärmten und befeuchteten Sauerstoff mit Flussraten von 40–60 l/min über eine spezielle Nasenkanüle (Cannula).
Die Qualität der Evidenz beim direkten Vergleich von NIV versus HFNO bezogen auf Sterblichkeit und Intubationsrate schätzt die Leitliniengruppe als niedrig ein. Im klinischen Alltag der Anwender nimmt die Leitliniengruppe eher eine Präferenz der Anwendung von HFNO im Vergleich zu NIV wahr. Dies führen die Autoren auf die unterschiedliche Compliance der Patienten zurück, die eine NIV/CPAP-Therapie nicht selten schwierig macht, wohingegen die HFNO-Therapie häufig einfacher vorzunehmen ist.
Die Leitlinienautoren erachten es als zu kurz gegriffen, die HFNO im Vergleich zur NIV als weniger personalintensiv einzustufen, nur weil sie einfacher erscheint, weniger Korrekturen erfordert und kein direktes Aspirationsrisiko im Falle von Erbrechen besteht. Auch oder gerade unter HFNO besteht die Gefahr einer muskulären Erschöpfung, weshalb Patienten ebenso intensiv zu betreuen und zu überwachen sind. Die Autoren betonen, dass alle an der Therapie beteiligten Personen die Zeichen eines drohenden NIV-Versagens (unter anderem steigende Atemfrequenz, abnehmende Tidalvolumina, Tachykardie, Schwitzen) erkennen müssen.
Sie weisen außerdem darauf hin, dass die Missachtung von Kontraindikationen bei nichtinvasiven Atmungsunterstützungsverfahren Risiken für Patienten birgt, und verweisen in diesem Zusammenhang auf die aktuelle S2k-Leitlinie „Nichtinvasive Beatmung als Therapie der akuten respiratorischen Insuffizienz“ [4].
Wichtig zu wissen: Über alle nichtinvasiven Verfahren hinweg zeigt sich ein positiver Effekt der Verringerung der Intubationsrate.
Empfehlung 24 – Schlüsselempfehlung:
Wir empfehlen: Keine Hochfrequenzbeatmung bei erwachsenen Patienten mit ARDS.
• Qualität der Evidenz: (hoch)
• Empfehlungsgrad: stark
Die High Frequency Oscillation Ventilation (HFOV) nutzt einen hohen Gasfluss, um einen konstanten, hohen Atemwegsdruck zu erzeugen und kollabierte Bereiche der Lunge wieder zu öffnen. Ein angeschlossener Oszillator bringt den Gasstrom in schnelle Schwingungen, sodass der Gasaustausch funktionieren sollte, ohne den Druck in der Lunge zu stark zu erhöhen und das Risiko einer beatmungsbedingten Lungenschädigung (Ventilator-Associated Lung Injury, VALI) zu steigern. Die HFOV wurde daher bislang bei schwerem ARDS eingesetzt, um die Lunge zu rekrutieren und die Sauerstoffversorgung zu verbessern, ohne zusätzliche Lungenschäden zu verursachen.
Hochwertige Evidenz zeigte jedoch keine Reduktion der Krankenhaus- oder 30-Tage-Sterblichkeit und zum Teil eine längere Beatmungs- sowie Intensivbehandlungsdauer infolge der Anwendung von HFOV. Zwar zeigte eine randomisierte, kontrollierte Studie eine Verbesserung der Oxygenierung, aber umgekehrt auch eine erhöhte Krankenhaussterblichkeit.
Daher ist nach Ansicht der Leitlinienautoren auch die Anwendung einer HFOV als Alternativ- oder Notfallverfahren zur Vermeidung einer refraktären Hypoxämie und Vorliegen einer Indikation für eine ECMO nicht gerechtfertigt. Für die Behandlung von Kindern ist die Datenlage widersprüchlich, sodass die Autoren weder eine Empfehlung für noch gegen eine HFOV aussprechen.
Empfehlung 28 – Schlüsselempfehlung:
Wir empfehlen, eine Kapnometrie/-grafie im Rahmen der Intubation zur Kontrolle der endotrachealen Tubuslage durchzuführen.
• Qualität der Evidenz: (niedrig)
• Empfehlungsgrad: stark
Die Kapnometrie bestimmt den Kohlendioxid-Partialdruck im Atemgas mithilfe der Infrarotspektrometrie. Die zusätzliche grafische Darstellung wird Kapnografie genannt. Trotz fehlender qualitativ hochwertiger Daten vergibt die Leitliniengruppe eine starke Empfehlung für die Anwendung der Kapnometrie/-grafie im Rahmen der endotrachealen Intubation. Gründe sind eine erhöhte Patientensicherheit, fehlendes Risiko und geringer materieller Aufwand.
Empfehlung 32 – Schlüsselempfehlung:
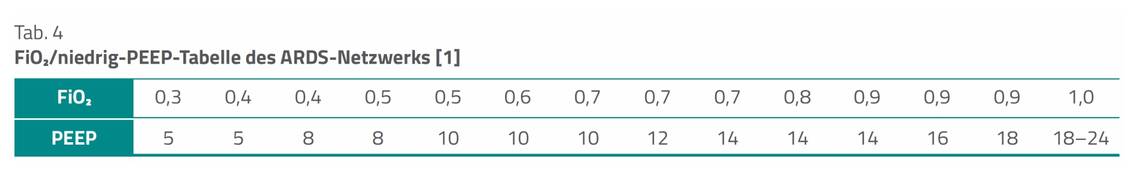
Wir schlagen vor, bei Patient:innen mit mildem ARDS eine orientierende Einstellung des PEEP mithilfe der FiO2/niedrig-PEEP-Tabelle des ARDS-Netzwerks zu erwägen.
• Vertrauenswürdigkeit der Evidenz: (niedrig)
• Empfehlungsgrad: schwach
Eine Reduktion der FRC ist laut den Leitlinienautoren eine typische Folge der Intubation, insbesondere wegen des fehlenden Glottisverschlusses, der Analgosedierung sowie der Flachlagerung. Die FRC-Reduktion begünstigt die Ausbildung von Atelektasen. Die Einstellung des PEEP nach der ARDS-Netzwerktabelle ist einfach zu bewerkstelligen, ist aber – so die Autoren – lediglich als eine orientierende Einstellungshilfe zu empfehlen, da sie individuelle atemmechanische Begebenheiten unberücksichtigt lässt.
Das ARDS-Netzwerk hat zwei PEEP-Tabellen vorgestellt, die unterschiedliche Werte für den positiven endexspiratorischen Druck vorschlagen. Je nach benötigter FiO2 können diese Tabellen zur Einstellung der Beatmung herangezogen werden, um einen Zielwerte von PaO2 55–80 oder SpO2 88–95 Prozent zu erreichen. Die FiO2/niedrig-PEEP-Tabelle zeigt Tabelle 4.
Empfehlung 33 – Schlüsselempfehlung (neu):
Wir empfehlen die Anwendung eines höheren PEEP bei Patient:innen mit moderatem und schwerem ARDS.
• Vertrauenswürdigkeit der Evidenz: (hoch)
• Empfehlungsgrad: stark
Die Leitlinienautoren weisen darauf hin, dass die Höhe des zu verwendenden PEEP anhaltend zu Uneinigkeit führt. Der „ideale“ PEEP ist der Atemwegsdruck, der eine Stabilisierung des zum exspiratorischen Kollaps neigenden Lungengewebes gewährleistet, ohne dabei die Gefahr einer inspiratorischen Überdehnung zu erhöhen. Die Eigenschaften des Lungengewebes sind jedoch individuell verschieden, worauf zurückgeführt wird, dass die Effekte erhöhter PEEP-Werte auf die Sterblichkeit von Patienten mit ARDS heterogen sind.
In Abschnitt 4.2.3 führt die Leitlinie bettseitige Methoden vor, um die Einstellung des PEEP bei Patienten mit mittelschwerem oder schwerem ARDS zu individualisieren.
Empfehlung 36 – Schlüsselempfehlung:
Wir empfehlen: Keine Durchführung von prolongierten (≥ 60 s) Rekrutierungsmanövern.
• Vertrauenswürdigkeit der Evidenz: (moderat)
• Empfehlungsgrad: stark
Empfehlung 37 – Schlüsselempfehlung (neu):
Wir schlagen vor: Keine routinemäßige Durchführung von kurzen (< 60 s) Rekrutierungsmanövern.
• Vertrauenswürdigkeit der Evidenz: (niedrig)
• Empfehlungsgrad: schwach
Alveoläre Rekrutierungsmanöver (RM) sind spezielle Beatmungsstrategien, die darauf abzielen, kollabierte Lungenbereiche (Atelektasen) wieder zu öffnen. Dabei wird in der Regel der Atemwegsdruck über den bei der invasiven Beatmung üblichen Spitzendruck hinaus erhöht.
Es gibt verschiedene Formen von Rekrutierungsmanövern mit unterschiedlicher Anwendungsdauer. Zwar lässt sich eine Rekrutierung atelektatischer Lungenareale auch mit Lagerungsmaßnahmen und Frühmobilisation, Spontanatmung und Surfactantgabe erzielen, jedoch bezieht die Leitlinie sich auf RM im engeren Sinne (durch invasive Beatmung vermittelte Rekrutierung).
Das zugrunde liegende Prinzip von RM ist die Tatsache, dass zur Eröffnung kollabierter Lungenareale höhere Drücke notwendig sind als zu ihrem Offenhalten. Daher stammt der alte Merksatz: Druck macht die Lunge auf, PEEP hält die Lunge auf. Jedoch können RM auch mit mehreren Mechanismen einhergehen, die zu einer beatmungsassoziierten Lungenschädigung führen. Außerdem kommt es häufig zur relevanten Senkung des Herzzeitvolumens infolge eines RM. Dabei basiert es auf unterschiedlichen individuellen Gegebenheiten (Ursache des Lungenversagens, Potenzial für Rekrutierung, globaler und regionaler Atemmechanik), ob die Vor- oder die Nachteile überwiegen.
Empfehlung 39 – Schlüsselempfehlung:
Wir schlagen vor, bei invasiv beatmeten Patient:innen eine SaO2/SpO2 von 92–96 Prozent oder einen PaO2 zwischen 70–90 mmHg (9.3–12 kPa) anzustreben.
• Vertrauenswürdigkeit der Evidenz: (sehr niedrig)
• Empfehlungsgrad: schwach
Der Organismus kann nicht nur durch zu wenig Sauerstoff Schaden erleiden, sondern auch durch ein Zuviel an Sauerstoff. In der Zusammenschau aller Ergebnisse kommt die Leitliniengruppe zu dem Schluss, dass der untere PaO2-Grenzwert 70 mmHg betragen soll, da eine Studie zeigte, dass ein darunter liegender Zielwert Hinweise auf ein möglicherweise erhöhtes Schädigungspotenzial ergab.
Eine Einstellung, die zu SaO2/SpO2 > 96 Prozent oder zu PaO2 > 90 mmHg (> 12 kPa) führt, ist ebenfalls nicht anzustreben.
Wichtig zu wissen: Den Autoren zufolge sollte eine pulsoxymetrische Sättigung von 100 Prozent unter Sauerstofftherapie strikt vermieden werden, da eine mögliche Verschlechterung der Oxygenierung unter Umständen nicht rechtzeitig zu erkennen ist.
Empfehlung 42 – Schlüsselempfehlung:Wir empfehlen, bei der invasiven Beatmung von Patient:innen mit ARDS den Plateaudruck (Pplat) ≤ 30 cm H2O zu halten.
• Vertrauenswürdigkeit der Evidenz: (moderat)
• Empfehlungsgrad: stark
Fachleute nehmen an, dass ein erhöhter Atemwegsdruck einer der Faktoren ist, die einen beatmungsassoziierten Lungenschaden hervorrufen. Somit ist es naheliegend, den Pplat bei der Beatmung zu begrenzen. Andererseits kann die Begrenzung des Pplat zu unerwünschten Ereignissen führen, etwa einem zu geringen Atemminutenvolumen, woraus dann wiederum eine Hyperkapnie entstehen kann. Ältere Studien, die vor dem Jahr 2006 veröffentlicht wurden, zeigten ein reduziertes Sterberisiko, wenn der Pplat < 30 cm H2O gehalten wurde.
Empfehlung 44 – Schlüsselempfehlung:
Wir schlagen vor, bei der invasiven Beatmung von Patient:innen mit ARDS eine inspiratorische Druckdifferenz von ≤ 14 cmH2O anzustreben.
• Vertrauenswürdigkeit der Evidenz: (sehr niedrig)
• Empfehlungsgrad: schwach
Die inspiratorische Druckdifferenz ΔP (Delta P gesprochen) ist die Differenz zwischen dem Atemwegsplateaudruck oder Inspirationsdruck und dem PEEP. Sie wird auch Driving Pressure genannt und ist die treibende Kraft für die inspiratorische Ausdehnung der Lunge, also für das Erzeugen eines Atemhubvolumens (Tidalvolumens). Dies lässt sich durch folgende Formeln ausdrücken:
- Volumenkontrollierte Beatmung: ΔP = Plateaudruck (Pplat) - PEEP
- Druckkontrollierte Beatmung: ΔP = Inspirationsdruck (Pinsp) - PEEP
Mehrere randomisierte kontrollierte Studien zeigten, dass die inspiratorische Druckdifferenz von den untersuchten Beatmungsvariablen am stärksten mit dem Überleben assoziiert war. Tidalvolumen und PEEP waren laut Leitliniengruppe nur dann mit einem Überlebensvorteil assoziiert, wenn deren Veränderung zu einer Verringerung der inspiratorischen Druckdifferenz führte. Die Festlegung des Zielwerts für die inspiratorische Druckdifferenz auf ≤ 14 cm H₂O (statt ≤ 15 cm H₂O in der Erstversion der Leitlinie) basiert auf einer erneuten Sichtung und Bewertung der Literatur.
Empfehlung 56 – Schlüsselempfehlung:
Wir empfehlen: Kein routinemäßiger Einsatz einer geschlossenen Absaugung bei invasiv beatmeten Patienten.
• Qualität der Evidenz: (niedrig)
• Empfehlungsgrad: stark
Bei geschlossenen Absaugungen ist der Absaugkatheter direkt mit dem Beatmungssystem verbunden und in einer transparenten Folie im Sinne eines geschlossenen Systems von der Außenwelt abgeschottet. Dies ermöglicht eine direkte Einführung des Katheters zum Absaugen in den Tubus oder die Trachealkanüle.
Der Vorteil eines geschlossenen Systems wird aus krankenhaushygienischer Sicht in der Vermeidung der Kontamination der Patientenumgebung mit Erregern durch das Aerosol beim Öffnen der Atemwege gesehen. Zudem soll der Schutz der Patienten vor einer exogenen Erregerübertragung durch die Hände des Personals gewährleistet sein. Die Autoren weisen darauf hin, dass insbesondere bei Patienten mit hochresistenten Erregern die Anwendung einer geschlossenen Absaugung den nationalen Empfehlungen des RKI entspricht und dies auch nachvollziehbar sei.
Jedoch sind die Ergebnisse der Studien heterogen, die ventilatorassoziierte Pneumonie (VAP) wurde in den Studien unterschiedlich definiert und patientenrelevante Outcome-Parameter (Beatmungsdauer oder beatmungsfreie Tage, Verweildauer auf Intensivstation, Krankenhausverweildauer, Sterblichkeit) sind bislang nicht ausreichend untersucht, um den Vorteil gegenüber einer offenen Absaugung zu belegen.
Spezialisten gefragt
Die vorliegende Leitlinie zeichnet sich durch ihren großen Umfang und die Vielzahl an Empfehlungen aus, die weit über die in diesem Beitrag angesprochenen Punkte hinausgehen. Um ein vollständiges Bild zu erhalten und die Inhalte im klinischen Alltag sinnvoll anwenden zu können, ist daher eine vertiefte Auseinandersetzung mit dem Originaldokument dringend empfohlen. Der vorliegende Beitrag versteht sich insofern als Anregung und Einladung, sich näher mit der Leitlinie zu beschäftigen und die dort aufgeführten Aspekte in ihrer Gesamtheit zu berücksichtigen.
Literatur:
[1] Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin e. V. (DGAI). S3-Leitlinie Invasive Beatmung und Einsatz extrakorporaler Verfahren bei akuter respiratorischer Insuffizienz (AWMF-Registernummer 001–021). Version 2.0. Im Internet: register.awmf.org/de/leitlinien/detail/001-021; Zugriff: 01.08.2025
[2] Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Ständige Kommission Leitlinien. AWMF-Regelwerk „Leitlinien“ (Version 2.2 vom 22.05.2025). Im Internet: www.awmf.org/leitlinien/awmf-regelwerk.html; Zugriff: 01.08.2025
[3] Alonso-Coello P, Oxman AD, Moberg J et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016; 353: i2089. doi:10.1136/bmj.i2089
[4] Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin e. V. (DGP): S2k-Leitlinie Nichtinvasive Beatmung als Therapie der akuten respiratorischen Insuffizienz (AWMF-Registernummer 020–004). Version 3.3 (redakt. überarb. Langfassung vom 04.01.2024). Im Internet: register.awmf.org/de/leitlinien/detail/020-004. Zugriff: 01.08.2025