Die im Zuge von Narkosen oft notwendige Sicherung der Atemwege ist eine wichtige Kernaufgabe des Krankenhauspersonals, die trotz aller Routine auch immer anfällig für Komplikationen bleibt. Auf Basis aktueller (inter)nationaler Daten geht der Beitrag auf die Besonderheiten und Herausforderungen des Atemwegsmanagements ein.
Täglich rund 40.000 Narkosen realisieren zumeist interdisziplinär zusammengesetzte Teams in den Anästhesieabteilungen deutscher Krankenhäuser [1]. Die Literatur beschreibt mehrfach schwere Zwischenfälle während des Atemwegsmanagements, die negative Folgen auf die Morbidität und Mortalität von Patientinnen und Patienten haben [2, 3]. Ursächlich für eine Vielzahl dieser Zwischenfälle bleibt weiterhin eine unzulänglich strukturierte Vorgehensweise zur situationsgerechten Sicherung der Atemwege [4].
Bereits seit 2010 fordert die „Helsinki Declaration on Patient Safety in Anesthesiology“ daher entsprechende Atemwegsalgorithmen für jede Institution [5]. Dieser Forderung sind die unterschiedlichen nationalen und internationalen Anästhesiegesellschaften und Berufsverbände in den vergangenen Jahren zunehmend in Form von Ablaufbeschreibungen zur Bewältigung von unerwarteten und erwarteten Atemwegsproblemen nachgekommen; zuletzt für Deutschland im Jahr 2015 Vertreterinnen und Vertreter der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) mit der mittlerweile ungültigen S1-Leitlinie Atemwegsmanagement [6].
Problemfelder der Atemwegssicherung
Intubation. Der sogenannte schwierige Atemweg beschreibt unterschiedliche Situationen, die im Zusammenhang mit den traditionellen Intubationstechniken wie Maskenbeatmung und Intubation unter Zuhilfenahme der direkten Laryngoskopie entstehen können.
Neben jener Situation, in der im Rahmen einer endotrachealen Intubation mehrere Versuche nötig sind, um einen Endotrachealtubus zu platzieren [7], fallen unter den schwierigen Atemweg auch die schwierige oder fehlgeschlagene Maskenbeatmung (FMV), der schwierige oder fehlgeschlagene Einsatz supraglottischer Atemwegshilfen (SGA), die schwierige oder fehlgeschlagene direkte Laryngoskopie oder Videolaryngoskopie (VL), die schwierige oder fehlgeschlagene tracheale Intubation, der notfallmäßige infraglottische Atemwegszugang sowie die „cannot ventilate – cannot oxygenate“-Situation (CVCO) [8].
Die schwierige oder fehlgeschlagene Beatmung mittels FMV oder SGA zeichnet sich durch ein fehlendes oder stark gedämpftes Kapnografiesignal aus [8]. Genaue Angaben zu den Inzidenzen dieser Beatmungsprobleme sind aufgrund uneinheitlicher Definitionen in der zugrunde liegenden Literatur erschwert.
Zur groben Einordnung lassen sich allerdings aus einigen Arbeiten die orientierenden Inzidenzen von rund 2 % für eine erschwerte Beatmung [9, 10] und von rund 0,15 % für eine unmögliche Beatmung mittels dieser Techniken heranziehen [9].
Mit einer Inzidenz von 1,5 bis 8 % stellt die Konfrontation mit einer schwierigen direkten Laryngoskopie [11, 12] und mit rund 6,2 % auch jene mit einer schwierigen Intubation [13] ein dahingehend noch häufiger auftretendes Problem innerhalb des Atemwegsmanagements dar. Als schwierig oder fehlgeschlagen gilt die Intubation dann, wenn eine erfahrene Anwenderin oder ein erfahrener Anwender den Patienten auch nach insgesamt drei Versuchen nicht intubieren kann [8].
Zu einer CVCO-Situation kommt es dann im Folgenden, wenn der Patient weder mittels FMV noch mittels SGA oder einem erfolgreich platzierten Tubus im Zuge der trachealen Intubation ventiliert werden kann und deshalb eine Hypoxie droht oder bereits eingetreten ist [8]. Lässt sich die „cannot-ventilate“-Situation frühzeitig detektieren, ermöglicht die rechtzeitige Anlage eines notfallmäßig applizierten infraglottischen Atemwegszugangs (eFONA) – etwa durch die Krikothyreotomie, das heißt die Öffnung der Atemwege in Höhe des Kehlkopfes oberhalb der Luftröhre, mittels Skalpell-Bougie-Tubus-Technik eine Verbesserung des Patientenoutcomes und die Vermeidung einer schweren Hypoxie [4, 8]. Auch wenn eine solche Situation mit sehr geringen Eintrittswahrscheinlichkeiten von 1:13.000 (0,008 %) bis 1:25.000 (0,004 %) assoziiert ist, bedarf es insbesondere für diese lebensrettenden Techniken regelmäßiger Trainings, um Sicherheit für den Notfall zu erlangen [9, 10].
Narkoseeinleitung. Um sich gegebenenfalls im Vorfeld einer Narkoseeinleitung gedanklich auf Herausforderungen einstellen zu können, sind in den vergangenen Jahren unterschiedliche Prädiktoren und Testverfahren beschrieben worden, die Anhaltspunkte für einen schwierigen Atemweg oder eine erschwerte FMV oder auch für eine schwierige Intubation beziehungsweise eine unmögliche direkte Laryngoskopie liefern sollen.
Hierzu zählen als Prädiktoren für die erschwerte FMV unter anderem Narben, Tumoren oder sonstige pathologische Veränderungen von der Trachea, des Pharynx und des Larynx, eine Markoglossie, ein Mallampati Grad III oder IV, ein erhöhtes Alter (> 55 Jahre) oder auch die Zahnlosigkeit beziehungsweise ein desolater Zahnstatus [9, 10].
Weitere Aspekte einer schwierigen Intubation sind eine eingeschränkte Mundöffnung sowie die reduzierte Reklinierbarkeit des Kopfes, eine verringerte tyreomentale Distanz (< 6–7cm), ein Stridor oder auch eine schwierige Intubation in der Krankengeschichte des Patienten [9, 10]. Dennoch sind die genannten Prädiktoren und Screening-Instrumente [14–18] aufgrund ihrer eingeschränkten Sensitivität beziehungsweise limitierenden Aussagekraft lediglich als Orientierungshilfen für die Ersteinschätzung im Zuge der anästhesiologischen Evaluation der Atemwege vor Beginn der Narkoseeinleitung zu verstehen [5].
Präoxygenierung. Von größerer Bedeutung scheint hier im Vergleich zu den Prädiktoren der Aspekt der Präoxygenierung des Patienten, um unabhängig vom Evaluationsbefund der Atemwege eine ausreichend lange Apnoetoleranz und somit ausreichend zeitliche Ressourcen für den potenziellen Komplikationsfall nach der Gabe der Narkoseinduktionsmedikamente erreichen zu können.
Neben der Präoxygenierung mit einer Sauerstofffraktion im Einatmungsgasgemisch (FiO₂) von 1,0 über die fest vorgehaltene FMV hat in den vergangenen Jahren auch die Präoxygenierung mittels High-flow-O2-Therapiegeräten über eine nasal platzierte Kanüle Einzug in die Praxis finden können. Eben jene High-flow-Präoxygenierung zeigte zuletzt aufgrund der Möglichkeit einer fortgesetzten apnoeischen Oxygenierung infolge ihres Verbleibs in der Nase während des Intubationsvorgangs einen Vorteil gegenüber der FMV [19].
Für eine unabhängig vom gewählten Hilfsmittel tunlichst lange Apnoetoleranz ist auf eine leicht erhöhte Oberkörperlagerung (Erhöhung der funktionellen Residualkapazität) zu achten, in der dann entweder in Form von acht maximal tiefen Atemzügen innerhalb von 60 Sekunden [20] oder über einen Zeitraum von drei bis vier Minuten die eigentliche Präoxygenierung erfolgt [21].
Auch wenn in den vergangenen Jahren negative Folgen einer Überoxygenierung in Kombination mit verschiedenen Krankheitsbildern nachweisbar waren [22], ist eine Präoxygenierung zugunsten des erwartbaren Zugewinns an Sicherheit infolge der verlängerten Zeit bis zur Desaturierung weiterhin sinnvoll [7].
Management des unerwartet schwierigen Atemwegs
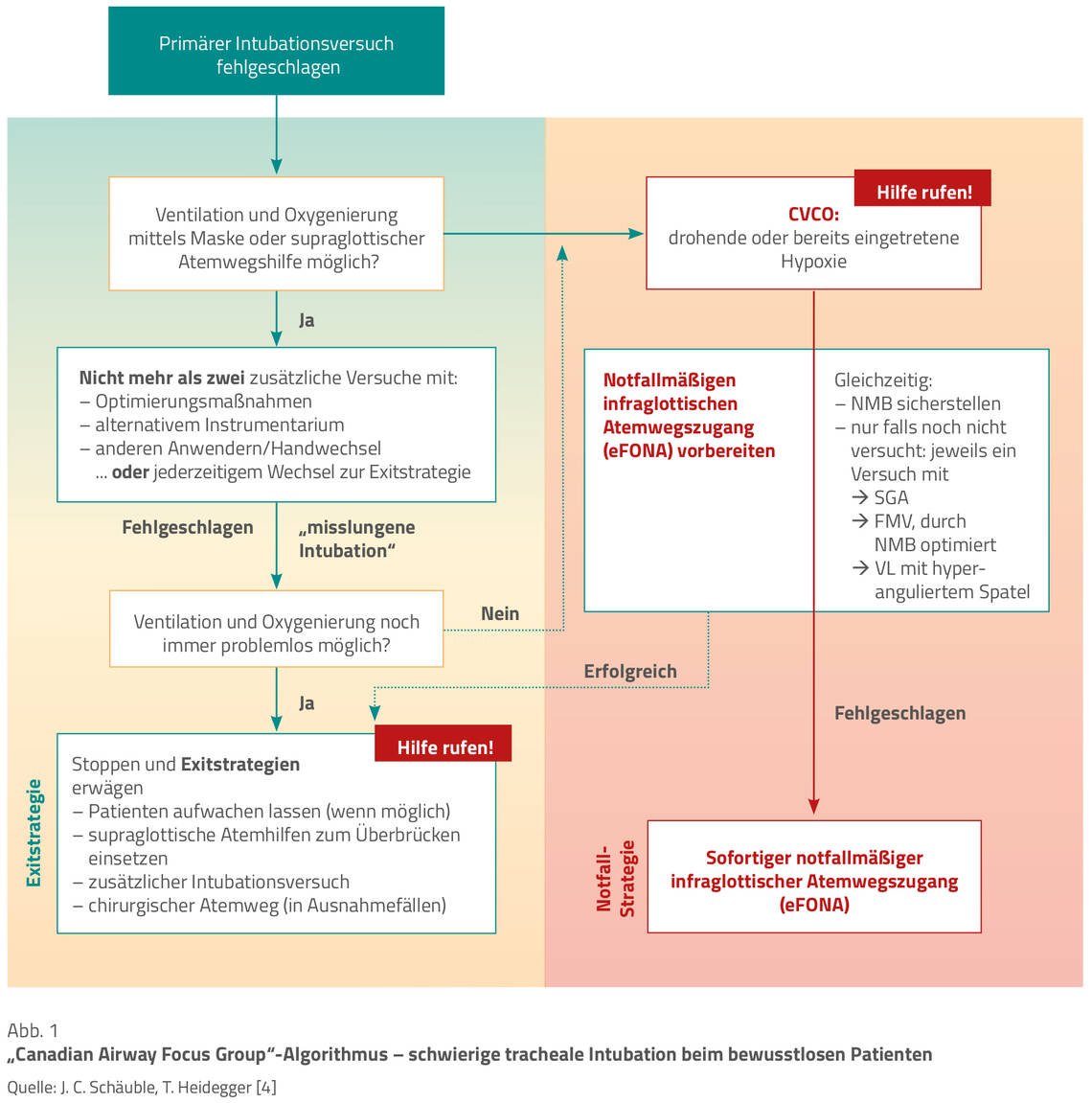
Die im Handlungsalgorithmus „schwierige tracheale Intubation beim bewusstlosen Patienten“ (Abb. 1) [8] dargestellte Vorgehensweise gliedert sich nach einem primär erfolglosen Intubationsversuch in zwei mögliche Ablaufvarianten. Ausschlaggebend für die jeweilige Wahl des Ablaufs ist die Frage, ob bereits eine CVCO-Situation vorliegt oder eine Ventilation oder Oxygenierung mittels FMV oder SGA weiterhin erfolgen kann. Während es sich bei der CVCO-Situation um eine absolute Notfallsituation handelt, schafft eine weiterhin sichergestellte Oxygenierung und Ventilation des Patienten zusätzliche zeitliche Ressourcen zur Planung weiterer Handlungsschritte (Exitstrategie).
Ist also im Anschluss an den erfolglosen Intubationsversuch eine Ventilation des Patienten mittels FMV oder SGA realisierbar, so ist ein erneuter Intubationsversuch frühestens dann ratsam, wenn die Sauerstoffsättigung (SpO₂) noch oder wieder in einem sicheren Bereich (> 90 %) liegt. Gleiches gilt auch, wenn der Patient nicht zwischenbeatmet wird oder werden muss, etwa weil eine im Vorfeld adäquate erfolgte Präoxygenierung oder eine apnoeische Oxygenierung die Sauerstoffsättigung des Patienten über dem Wert von 90 % hält.
Für die Optimierung weiterer Versuche zur Sicherung der Atemwege sind vermeintliche Ursachen, die zum initial fehlgeschlagenen Intubationsversuch geführt haben könnten, möglichst zu beheben und ist mit dem Einsatz apnoeischer Oxygenierungstechniken (5–15 l/min via Nasenbrille oder 50–70 l/min via High-Flow-System) zu beginnen [23].
Ergänzend können die Verbesserung der Kopflagerung, das Absaugen von Sekret, die Verwendung eines Führungsstabs oder auch äußere Larynxmanipulationen wie das OELM-(optimal external laryngeal manipulation) und das BURP-(backward upward rightward pressure) Manöver zur Verbesserung der Erfolgschancen der direkten Laryngoskopie beitragen [3, 6, 24].
Da im weiteren Verlauf die Zahl wiederholter Versuche zur Atemwegssicherung mit einer erhöhten Rate an Komplikationen assoziiert ist [2], sollte ein dritter Versuch grundsätzlich nur unter Wechsel des Anwenders oder der einzusetzenden Technik erfolgen. Je unerfahrener das interdisziplinäre Anästhesieteam ist, desto eher empfiehlt sich die frühzeitige Mobilisierung zusätzlicher personeller Ressourcen zur weiteren Unterstützung. Im Algorithmus ist die Hilfe einer Expertin oder eines Experten (zum Beispiel einer Oberärztin oder eines Oberarztes) spätestens nach dem dritten erfolglosen Versuch einzuholen. Ist die Ventilation während dieser Zeit weiterhin problemlos realisierbar, sind eine Beendigung der Narkose sowie die Wahl einer Exitstrategie zu erwägen [8].
Sind Ventilation und Oxygenierung des Patienten entweder nach dem ersten oder den dann anschließenden Versuchen zur Sicherung der Atemwege nicht sicherzustellen, so handelt es sich hierbei um einen Notfall (CVCO-Situation), der mit Verfolgung einer entsprechend festgelegten Notfallstrategie (Abb. 1) zu behandeln ist. Die „cannot ventilate – cannot oxygenate“-Situation definiert sich als bereits eingetretene oder drohende Hypoxie mit einer SpO₂ < 90 % aufgrund mehrfach gescheiterter Ventilations- oder misslungener Intubationsversuche. Weitere Hilfe ist in diesem Fall unmittelbar anzufordern.
Anschließend kann der erfahrenste und unmittelbar vor Ort befindliche Anwender mit der Identifikation notwendiger Landmarken am Patienten beginnen. Parallel dazu bereitet die Anästhesiepflegefachperson die Materialien für den notfallmäßigen infraglottischen Atemwegszugang vor, sodass der Anwender mit diesen die Atemwege sichern kann.
Management des erwartet schwierigen Atemwegs
Lassen sich im Rahmen der präoperativen Atemwegsevaluation unter Berücksichtigung verschiedener Scoring-Systeme und Prädiktoren [9, 10, 14–18] Probleme während der FMV, beim Einsatz von SGA, bei der endotrachealen Intubation oder bei Anlage eines eFONA antizipieren, so liegt jeweils ein erwartet schwieriger Atemweg vor.
Sollte in einem dieser Fälle die Operation unter Berücksichtigung verschiedener verfügbarer Regionalanästhesieverfahren nicht möglich sein, bedarf es einer anästhesiologischen Entscheidungsfindung, ob der Atemweg am wachen und spontanatmenden Patienten oder erst nach Einleitung der Narkose erfolgen kann. In diese Entscheidungsfindung sollten neben der kritischen Überprüfung der Indikation zur Wachintubation auch etwaige physiologische und/oder fallbezogene Risikofaktoren des Patienten mit eingeschlossen werden. Während der Wachintubation ist es notwendig, dass der Patient bei ausreichend Bewusstsein und in der Lage ist, seinen Atemweg selbst offen zu halten, gegen Aspirationen zu schützen sowie suffizient spontan zu atmen.
Dieses setzt neben einer entsprechenden Patientencompliance und -toleranz auch ausreichend zeitliche Ressourcen sowie die Zusammensetzung eines möglichst erfahrenen interdisziplinären Teams für das Atemwegsmanagement voraus. Als Goldstandard für die tracheale Wachintubation gilt hier die Intubation mittels eines flexiblen Intubationsendoskops (fiberoptische Wachintubation), die sowohl nasal als auch oral erfolgen kann [25]. Ergänzend ist auch die Atemwegssicherung über einen infraglottischen (eFONA-) Zugangsweg denkbar.
Ist aufgrund einer eingeschränkten Compliance eine Wachintubation nicht realisierbar und ist trotz erwartbarer Schwierigkeiten eine Intubation erst nach Anästhesieeinleitung geplant, sollten Einleitung und Legen der Narkose am ehesten mittels eines „double-setups“ erfolgen.
Dieses umfasst eine angemessene, klar definierte und kommunizierte Vorgehensweise bei der Atemwegssicherung unter ergänzender Benennung potenzieller Trigger für einen Wechsel der Technik oder der Eskalationsstufe.
Weiterhin sind hier angemessene personelle und logistische Voraussetzungen zu schaffen – etwa die Präsenz zweier erfahrener Anwender oder Anästhesisten sowie einer erfahrenen Anästhesiepflegefachperson – unter Gewährleistung einer Krikothyreotomiebereitschaft [8].
Letztere ist zum Beispiel herzustellen über ein bereitgestelltes und unmittelbar einsatzbereites Krikothyreotomie-Set im Einleitungsraum sowie die Anwesenheit eines im Notfall unmittelbar übernehmenden Hals-Nasen-Ohren- oder Mund-Kiefer-Gesichtschirurgen.
Extubation nach vorherigem (unerwartet) schwierigen Atemweg
Rund ein Drittel der Patienten zeigt sich nach einem schwierigen Atemwegsmanagement in der Zeit unmittelbar nach der Extubation und der anschließenden Aufwachphase als anfällig für schwerwiegende Zwischenfälle [6, 8]. Zur Evaluation geeigneter Extubationsvoraussetzungen sind in den Leitlinien unterschiedliche Verfahren beschrieben. Neben der Beurteilung des supraglottischen Bereichs mittels Videolaryngoskop [3, 6] kann zudem ein Nebenlufttest helfen, ein Larynxödem oder generelle Ödeme im Bereich der Atemwege zu erkennen. Beim zuletzt genannten Testverfahren wird der Cuff zuvor entblockt und über sechs Atemzüge die Differenz aus in- und exspiratorischen Tidalvolumen errechnet. Bei einer Differenz von mehr als 110 ml Nebenluftvolumen pro Atemzug ist von einem geringen Risiko für das Vorliegen eines Larynxödems auszugehen [6].
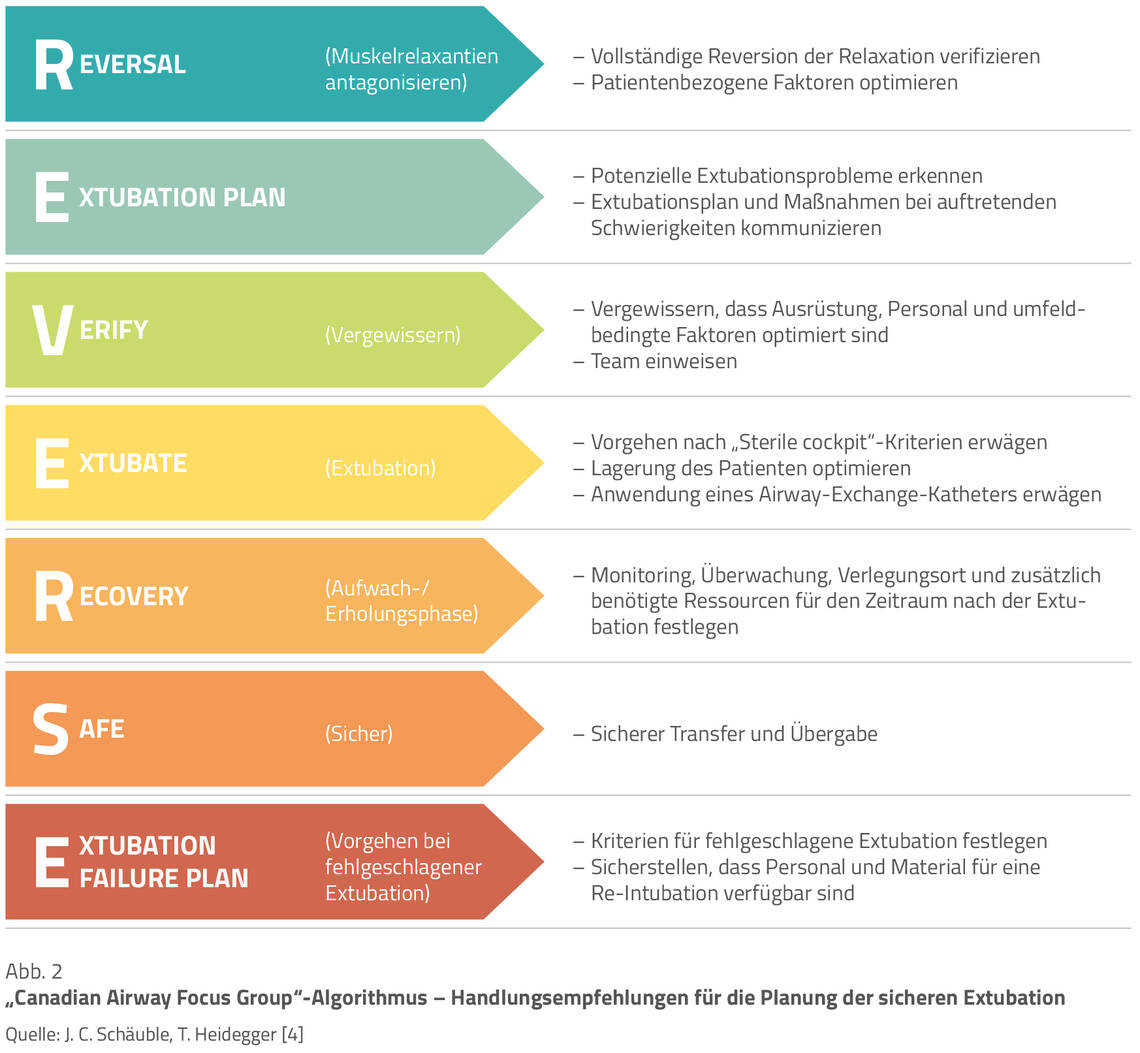
Neben der Berücksichtigung der Empfehlungen für eine voraussichtlich erschwerte Extubation (Abb. 2) sollte überprüft werden, ob eine Extubation grundsätzlich zu tolerieren ist beziehungsweise bei einer erforderlichen Re-Intubation mit erneuten Problemen einhergehen könnte. Als Hilfsmittel ist auch die endotracheale Platzierung eines speziellen Airway-Exchange-Katheters in Erwägung zu ziehen, der bei entsprechender Toleranz des Patienten sowohl als Führungshilfe für eine optionale Re-Intubation als auch zur Sauerstoffapplikation dienen kann [8].
Nach der Extubation ist der Patient über das Vorliegen eines schwierigen Atemwegs zu informieren. Außerdem sollte er einen entsprechenden Anästhesieausweis erhalten, in dem Hinweise über die erfolgreichen Maßnahmen zur Sicherung der Atemwege dokumentiert sind [3, 6].
Tools innerhalb des klinischen Atemwegsmanagements
Supraglottische Atemwegshilfen (SGA). Unter diesem Oberbegriff lassen sich alle Ventilationshilfen zusammenfassen, die ein Offenhalten der Atemwege im Bereich des Oropharynx und des proximalen Ösophagus ermöglichen. Neben dem Larynx- und Kombitubus, die vermehrt in der Präklinik zum Einsatz kommen, gehören dazu auch unterschiedliche Larynxmaskentypen.
Im Zusammenhang mit dem Atemwegsmanagement in der Klinik sprechen sich unter anderem die Autoren der deutschen S1-Leitlinie zum Atemwegsmanagement [6] sowie die Canadian Airway Focus Group in ihren kürzlich veröffentlichten Leitlinien für die Anlage von SGA der zweiten Generation aus [8]. Diese Hilfsmittel erlauben je nach Modell im Idealfall neben der Einlage einer Magensonde auch eine blinde Intubation oder eine Intubation mit einem flexiblen Intubationsendoskop über die positionierte Atemwegshilfe.
Videolaryngoskope (VL). Videolaryngoskope zählen seit einigen Jahren mit ihrer Kombination aus Lichtquelle und einer kleinen Kamera im Laryngoskopspatel zum etablierten Equipment innerhalb des Atemwegsmanagements. Sie kommen als sogenannte Rettungstechnik vor allem beim unerwartet schwierigen Atemweg zur Anwendung, etwa wenn nach einer schwierigen oder missglückten Laryngoskopie eine Verbesserung der Sichtverhältnisse auf die Glottis notwendig ist [26, 27].
Hierfür stehen auf dem Markt verschiedene VL zur Verfügung, die sich etwa aufgrund ihrer unterschiedlichen Spatelform und somit in ihrer Möglichkeit zur direkten (macintosh-ähnlicher Spatel) oder indirekten (stark gekrümmter Spatel) Glottisansicht unterscheiden lassen. Setzt die Intubation mittels stark gekrümmter Spatel neben der Nutzung eines Führungsstabs auch eine notwendige Anwendungserfahrung des Anästhesisten voraus, so sind Videolaryngoskopen mit macintosh-ähnlichen Spateln den Anwendern häufig vertrauter und somit oftmals leichter anwendbar [1, 6].
Unabhängig vom Erfahrungsstand des Anwenders sind jedoch Skilltrainings und Anleitungen der Kolleginnen und Kollegen notwendig, um einen sicheren Einsatz in kritischen Situationen gewährleisten zu können [4, 28].
Positive Auswirkungen einer routinehaften VL-Anwendung und somit der Gelegenheit, regelmäßig mit den Tools zur Atemwegssicherung auch unter Routinebedingungen zu arbeiten, zeigten sich in einer Kohortenstudie aus dem Jahr 2022. In dieser kam die Videolaryngoskopie als Intubationsverfahren der ersten Wahl zum Einsatz.
Dieses Vorgehen reduzierte das Auftreten schwieriger Atemwege und führte zu einer Abnahme der festgestellten Cormack-Lehane-Grade III und IV. Diese Klassifikation – unterteilt in die Grade I bis IV – beschreibt die direkte Sichtbarkeit von Elementen des Kehlkopfes, insbesondere der Stimmritze, unter konventioneller Laryngoskopie während einer endotrachealen Intubation. Zudem stieg der Anteil leichter Atemwege in der Interventionskohorte signifikant von 94,3 auf 98,7 % an [29].
Auch eine kürzlich veröffentlichte Metaanalyse bestätigte diese Ergebnisse und konnte die Überlegenheit der VL bei der Visualisierung der Glottisebene sowohl im Rahmen von normalen wie auch schwierigen Intubationssituationen feststellen [30].
Translaryngeale/transtracheale Techniken. Die Sicherung der Atemwege mithilfe translaryngealer oder transtrachealer Techniken (eFONA) stellt die Ultima Ratio innerhalb des Atemwegsmanagements dar und umfasst im Rahmen der Krikothyreotomie nach Durchtrennung des Lig. Cricothyroideum zwischen Schild- und Ringknorpel die Einführung einer Kanüle oder eines Tubus unterhalb der Glottisebene in den Atemweg [6].
Diese Notfallmaßnahme obliegt hierbei dem erfahrensten, unmittelbar anwesenden Anwender, der je nach einrichtungsinternem Standard auf eines von insgesamt drei verschiedenen Verfahren zurückgreifen kann [4]. Neben der chirurgischen Krikothyreotomie stehen Krikothyreotomie-Verfahren mittels „Catheter-over-needle-Technik“ (Nadel-Krikothyreotomie) oder mittels „Skalpell-Bougie-Tubus-Technik“ zur Auswahl [4, 8, 31]. In den internationalen Leitlinien zum schwierigen Atemweg [8, 31] wird jedoch ausschließlich zur zuletzt genannten Vorgehensweise geraten.
Human Factor im Atemwegsmanagement
Zwischen 40 und 100 % aller unerwünschten Ereignisse (adverse events) beim Atemwegsmanagement stehen im Zusammenhang mit „human factors“ [2]. Regelmäßige interdisziplinäre Teamtrainings, etwa in Skills Labs oder Trainingszentren, optimieren die Teamperformance und -dynamik und fördern Sicherheit und Routine etwa in der Anwendung seltener Narkosetechniken oder in der Lösung von Narkosezwischenfällen (fiberoptische Wachintubation oder unerwartet schwieriger Atemweg).
Die im Zuge solcher Trainings gewonnenen individuellen Erkenntnisse über die eigenen Fähigkeiten und Grenzen hinsichtlich der Handhabung kritischer Patientensituationen können helfen, bei Vorliegen von Unsicherheiten frühzeitig zusätzliche personelle Ressourcen zur Bewältigung der Situation zu mobilisieren und so das höchste Maß an Patientensicherheit zu gewährleisten [3, 6, 28]. Hilfreich kann zudem die präoperative Verteilung von Führungsrollen in Kombination mit einer personengebundenen Aufgabenverteilung sowie die Besprechung des geplanten Vorgehens unter Erwähnung verschiedener Rückfallebenen und Eskalationsstufen sein [28].
[1] Berufsverband Deutscher Anästhesisten (BDA) und Deutsche Gesellschaft für Anästhesiologie & Intensivmedizin (DGAI). Pressemitteilung: 175 Jahre Anästhesie. Informationen und Interviews zur Erinnerung an die erste Narkose 1846 (2021). Im Internet: www. dgai.de/aktuelles-2/1609-pressemappe-175-jahre-anaesthesie-2021/file. html; Zugriff: 16.04.23
[2] Joffe AM, Aziz MF, Posner KL et al. Management of Difӿcult Tracheal Intubation-A Closed Claims Analysis. Anesthesiology 2019; 131 (4): 818–829
[3] Apfelbaum JL, Hagberg CA, Connis RT et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difӿcult Airway. Anesthesiology 2022; 136 (1): 31–81
[4] Schäuble JC, Heidegger T. Management des schwierigen Atemwegs – die aktualisierten Handlungsempfehlungen der Canadian Airway Focus Group. Anästhesiologie und Intensivmedizin 2022; 63: 225–263. DOI: 10.19224/ai2022.255
[5] Mellin-Olsen J, Staender S, Whitaker DK et al. The Helsinki Declaration on Patient Safety in Anaesthesiology. Eurpean Journal of Anaesthesiology 2010; 27 (7): 592–597
[6] Piepho T, Cavus E, Noppes R et al. S1-Leitlinie Atemwegsmanagement. Anästhesist 2015; 64 (11): 859–873
[7] Grensemann J, Simon M, Kluge S. Atemwegssicherung in der Intensiv- und Notfallmedizin – Was gibt es Neues? Medizinische Klinik – Intensivmedizin und Notfallmedizin 2019; 114 (2): 334–341
[8] Law JA, Duggan LV, Asselin M et al. Canadian Airway Focus Group updated consensus-based recommendations for management of the difӿcult airway: part 1. Difӿcult airway management encountered in an unconscious Patient. Candian Journal of Anesthesiology 2021; 68 (9): 1373–1404
[9] Kheterpal S, Han R, Tremper KK et al. Incidence and predictors of difficult and impossible mask ventilation. Anesthesiology 2006; 105 (5): 885–891
[10] Kheterpal S, Healy D, Aziz MF et al. Multicenter Perioperative Outcomes Group (MPOG) Perioperative Clinical Research Committee. Incidence, predictors, and outcome of difficult mask ventilation combined with difficult laryngoscopy: a report from the multicenter perioperative outcomes group. Anesthesiology 2013; 119 (6): 1360–1369
[11] Lavery GG, McCloskey BV. The difficult airway in adult critical care. Critical Care Medicine 2008; 36 (7): 2163–2173
[12] Adnet F, Racine SX, Borron SW et al. A survey of tracheal intubation difficulty in the operating room: a prospective observational study. Acta Anaesthesiology Scandinavian 2001; 45 (3): 327–332
[13] Baker P. Preparedness and education in airway management. Anesthesiology Clinics 2015; 33 (2): 381–395
[14] Khan ZH, Kashfi A, Ebrahimkhani E. A comparison of the upper lip bite test (a simple new technique) with modified Mallampati classification in predicting difficulty in endotracheal intubation: a prospective blinded study. Anesthesiology 2003; 96 (2): 595–599
[15] Reissell E, Orko R, Maunuksela EL et al. Predictability of difficult laryngoscopy in patients with long-term diabetes mellitus. Anaesthesia 1990; 45 (12): 1024–1027
[16] Vani V, Kamath SK, Naik LD. The palm print as a sensitive predictor of difficult laryngoscopy in diabetics: a comparison with other airway evaluation indices. Journal Postgrad Medicine 2000; 46 (2): 75–79
[17] Wilson ME, Spiegelhalter D, Robertson JA et al. Predicting difficult intubation. British Journal of Anaesthesia 1998; 61 (2): 211–216
[18] Shiga T, Wajima Z, Inoue T, Sakamoto A. Predicting difficult intubation in apparently normal patients: a meta-analysis of bedside screening test performance. Anesthesiology 2005; 103 (2): 429–437
[19] Simon M, Wachs C, Braune S et al. High-flow nasal cannula versus bag-valve-mask for preoxgenation before intubation in subjects with hypoxemic respiratory failure. Respiratory Care 2016; 61 (9): 1160–1167
[20] Pandit JJ, Duncan T, Robbins PA. Total oxygen uptake with two maximal breathing techniques and the tidal volume breathing technique: a physiologic study of preoxygenation. Anesthesiology 2003; 99 (4): 841–846
[21] Tanoubi I, Drolet P, Donati F. Optimizing preoxygenation in adults. Canadian Journal of Anaesthesia 2009; 56 (6): 449–466
[22] Grensemann J, Fuhrmann V, Sydow K et al. Oxygen therapy in acute myocardial infarction. Medizinische Klinik Intensivmedizin Notfallmedizin 2017; 112 (1): 50–52
[23] Milette BH, Athanassoglou V, Patel A. High-flow nasal oxygen therapy in adult anaesthesia. Trends in Anaesthesiology and Critical Care 2018; 18: 29–33
[24] Vasudevan A, Venkat R, Badhe AS. Optimal external laryngeal manipulation versus McCoy blade in active position in patients with poor view of glottis on direct laryngoscopy. Indian J Anaesth 2010; 54 (1): 45–48. doi: 10.4103/0019–5049.60497
[25] Weller A, Walther A, Georgi R. Fiberoptische Intubation des spontan atmenden Patienten – Schritt für Schritt. Pneumologie 2017; 71 (9): 600–609. doi: 10.1055/s-0042–123427
[26] Aziz MF, Brambrink AM, Healy DW et al. Success of Intubation Rescue Techniques after Failed Direct Laryngoscopy in Adults: A Retrospective Comparative Analysis from the Multicenter Perioperative Outcomes Group, Anesthesiology 2016; 125 (4): 656–666
[27] Raimann FJ, Dietze PE, Cuca CE et al. Prospective Trial to Compare Direct and Indirect Laryngoscopy Using C-MAC PM® with Macintosh Blade and D-Blade® in a Simulated Difficult Airway. Emergency Medicine International 2019: 1067473
[28] St. Pierre M, Breuer G [Hrsg.]. Simulation in der Medizin. Grundlegende Konzepte – Klinische Anwendung. Springer; 2013. doi: 10.1007/978–3–642–29436–5
[29] De Jong A et al. Videolaryngoskopie as first-intention technique for tracheal intubation in unselectedsurgical patients: a before and after observational study. British Journal of Anesthesia 2022; 129 (4): 624–634
[30] Hansel J, Rogers AM, Lewis SR et al. Videolaryngoscopy versus direct laryngoscopy for adults undergoing tracheal intubation, Cochrane Database Syst Review 2022; 4 (4): Cd011136
[31] Frerk C, Mitchell VS, McNarry AF et al. Difficult Airway Society 2015 guidelines for managment of unanticioated difficult intubation in adults. Br J Anaesth 2015; 115 (6): 827–848. doi: 10.1093/bja/aev371