Die neue S3-Leitlinie Lagerungstherapie und Mobilisation von kritisch Erkrankten auf Intensivstationen ersetzt die bisherige S2e-Leitlinie, um Qualität und Sicherheit der Lagerungs- und Mobilisationstherapie weiter zu verbessern. Die Autorenschaft stellt wesentliche Veränderungen zur Vorversion vor und benennt die wichtigsten Empfehlungen.
Die Autorinnen und Autoren der neue Leitlinie haben eine Reihe von Empfehlungen der Vorgängerversion überarbeitet sowie einige neue Aspekte aufgenommen. Sie unternahmen eine differenziertere und umfassendere Betrachtung der Frühmobilisation und rückten sie – neben der Bauchlagerung – als zentralen interdisziplinären Ansatz der Intensivmedizin in den Mittelpunkt. Neu ist die Empfehlung, eine medizinisch notwendige Immobilisation explizit anzuordnen, die einen Paradigmenwechsel markiert und fixiert. Weitere wesentliche Veränderungen sind konkrete Empfehlungen zur Oberkörperhochlagerung ≥40°, der Verzicht auf die kontinuierliche laterale Rotationstherapie (KLRT) und eine differenziertere Empfehlung zur Dauer der Bauchlagerung. Im Aufbau verfolgt die S3-Leitlinie im Vergleich zur Vorgängerversion eine etwas veränderte Systematik. Sie beginnt mit dem Kapitel Lagerung, an das sich das Kapitel Mobilisation anschließt. Neu sind eigenständige Kapitel zu den Themen Hilfsmittel und neuromuskuläre Elektrostimulation (NMES).
Upgrade S2e auf S3
Die Lagerung und Mobilisation kritisch erkrankter Patientinnen und Patienten auf der Intensivstation ist ein wichtiger Bestandteil der heutigen Intensivmedizin. Seit Veröffentlichung der S2e-Leitlinie Lagerungstherapie und Frühmobilisation zur Prophylaxe oder Therapie von pulmonalen Funktionsstörungen im Jahr 2015 [1] haben sich neue Behandlungsprinzipien etabliert und es gibt neue Evidenzen in vielen Bereichen der Lagerungs- und Frühmobilisationstherapie.
Die neu erstellte S3-Leitlinie berücksichtigt diese Entwicklungen und bringt die Empfehlungen auf den neuesten Stand für eine sichere und qualitativ hochwertige Lagerungs- und Mobilisationstherapie, die sich positiv auf wichtige Endpunkte wie Funktionalität, Lebensqualität, Kognition, Beatmungsdauer oder die Intensivstations- sowie Krankenhausverweildauer auswirken kann.
Die Leitlinie ist für erwachsene Intensivpatienten (≥18 Jahre) konzipiert und richtet sich an alle Mitglieder der interdisziplinären und interprofessionellen Behandlungsteams, die an der Indikationsstellung und Durchführung der Lagerungs- und Frühmobilisationstherapie beteiligt sind. Diese sollen die überarbeiteten Empfehlungen als Teil ihrer Aufgabe im Kontext der jeweiligen Verantwortung und Kompetenzen und als Behandlungsstandard verstehen und anwenden. Die Mobilisation ist dabei als Teamaufgabe zu verstehen und die Empfehlungen dienen als Leitfaden für eine erfolgreiche Therapie.
Lagerungstherapie konkretisiert
Das Kapitel Lagerung baut die Teilaspekte Oberkörperhochlagerung, Seitenlagerung, Rückenlagerung, KLRT und Bauchlagerung systematisch auf und ermöglicht so eine differenziertere Betrachtung.
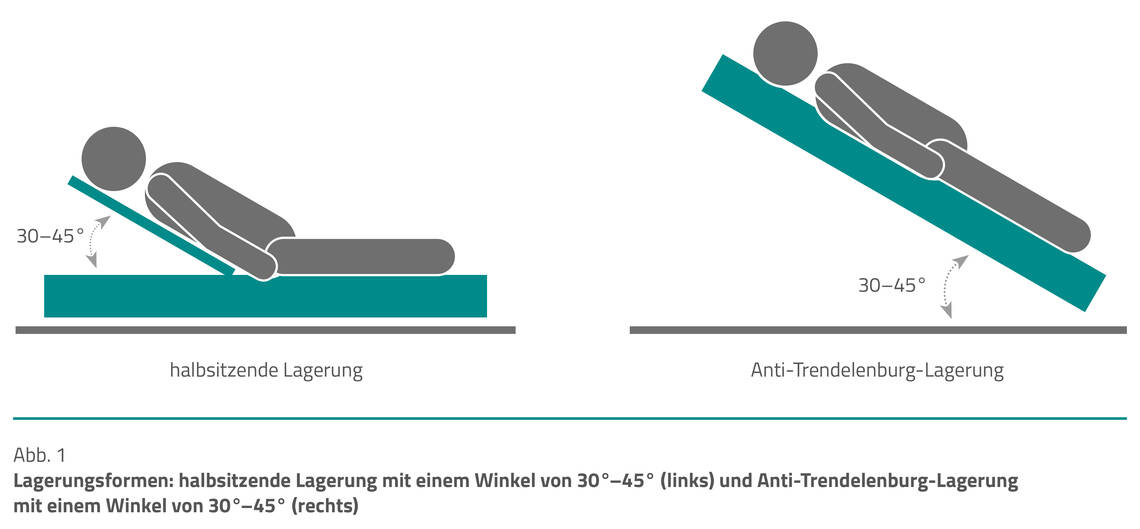
Oberkörperhochlagerung. Eine Oberkörperhochlagerung (Abb. 1) kann sowohl positive als auch negative Auswirkungen auf verschiedene Organsysteme haben. Sie ist geeignet, die Lungenbelüftung zu verbessern, das Risiko einer Aspiration zu verringern, den Reflux und die Regurgitation zu reduzieren sowie den intrakraniellen Druck und den Perfusionsdruck zu verringern.
Allerdings kann eine Oberkörperhochlagerung auch dazu führen, dass sich
- der venöse Rückstrom,
- das Herzzeitvolumen,
- der Blutdruck und
- die periphere Sauerstoffversorgung reduzieren sowie
- der abdominelle Druck und
- das Risiko für Druckgeschwüre an Steiß und Fersen erhöhen.
Die S3-Leitlinie enthält dazu präzise und konkrete, patientenadaptierte Empfehlungen mit unterschiedlichen Empfehlungsstärken und Evidenzgraden.
Empfehlung 1.1
Wir empfehlen bei intubierten Patient:innen eine Oberkörperhochlagerung ≥40° unter Abwägung möglicher hämodynamischer Nebenwirkungen und eines erhöhten Risikos für Druckulzera.
Empfehlungsgrad: stark, Evidenzgrad: 1
Seitenlagerung. Eine Seitenlagerung verfolgt unterschiedliche Ziele. Neben einer Druckentlastung zur Dekubitusprophylaxe soll sie die pulmonale Situation verbessern. Die Evidenz zu positiven Wirkungen auf die pulmonale Situation ist jedoch begrenzt. Studien haben bislang lediglich die Bedeutung einer Seitenlagerung zur Verhinderung einer beatmungsassoziierten Pneumonie (VAP) untersucht und haben ansonsten nur eingeschränkte Aussagekraft [3].
Die Autoren der S3-Leitlinie haben daher die Empfehlungen zur Seitenlagerung aus der vorhergehenden S2e-Leitlinie teils beibehalten, teils konkretisiert.
Die Leitlinie
Am 25. Juli veröffentlichte die Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) als federführende Institution die S3-Leitlinie Lagerungstherapie und Mobilisation von kritisch Erkrankten auf Intensivstationen auf der Website der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Zehn weitere medizinische und pflegerische Organisationen, darunter die Deutsche Gesellschaft für Fachkrankenpflege und Funktionsdienste (DGF), die Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI), die Deutsche Gesellschaft für Neurointensiv- und Notfallmedizin (DGNI) und die Deutsche Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN), haben an der Überarbeitung mitgewirkt. Die Langfassung der Leitlinie hat einen Umfang von 134 Seiten und steht auf der Website der AWMF kostenlos als Download zur Verfügung [2].
KLRT. Die Leitlinie von 2015 empfahl die KLRT als präventive Maßnahme. Aufgrund neuerer Erkenntnisse sieht die S3-Leitlinie von dieser Empfehlung ab. Die KLRT ist eine Methode, die Patienten kontinuierlich um ihre Längsachse in einem motorgetriebenen Bettsystem dreht, um pulmonale Komplikationen zu vermeiden und den Gasaustausch zu verbessern. Eine Entscheidung zur Anwendung von KLRT ist sorgfältig abzuwägen, da sie nur bei tief sedierten Patienten möglich ist und mit unerwünschten Wirkungen wie Agitation, längere Beatmungsdauer und längere Verweildauer auf der Intensivstation einhergehen kann. Daher ist die Indikation gezielt zu stellen und täglich zu überprüfen.
Studien haben gezeigt, dass KLRT zu unerwünschten Wirkungen führen kann, ohne Vorteile im Vergleich zur üblichen Versorgung zu bieten [4, 5].
Empfehlung 1.7
Wir schlagen vor, eine kontinuierliche laterale Rotationstherapie nicht anzuwenden.
Empfehlungsgrad: schwach, Evidenzgrad: 2
Bauchlagerung. Die Bauchlagerung stellt aufgrund der vielfältigen physiologischen Effekte, die sich positiv auf die respiratorische Situation von Patienten mit akutem schweren Atemnotsyndrom auswirken können, weiterhin eine zentrale Behandlungsoption in der Intensivmedizin dar und nimmt daher in der S3-Leitlinie einen großen Raum ein.
Dazu gehört auch die sogenannte PROSEVA-Studie. Diese untersuchte, welche Auswirkungen die Bauchlage auf die Sterblichkeitsrate von Patienten mit akutem schweren Atemnotsyndrom (ARDS) hat [6]. Teilnehmende dieser Untersuchung waren insgesamt 237 Patienten in Bauchlagerung sowie 229 Patienten in Rückenlagerung.
Die 28-Tage-Mortalität betrug in der Bauchlage-Gruppe 16,0 Prozent und in der Rückenlage-Gruppe 32,8 Prozent. Die nichtadjustierte 90-Tage-Mortalität betrug 23,6 Prozent in der Bauchlage-Gruppe gegenüber 41,0 Prozent in der Rückenlage-Gruppe. Die Inzidenz von Komplikationen unterschied sich nicht signifikant zwischen den Gruppen. Eine Ausnahme bildete die höhere Inzidenz von Herzstillständen in der Rückenlage-Gruppe.
Die Ergebnisse zeigen, dass die frühzeitige Anwendung der Bauchlage bei Patienten mit schwerem ARDS zu einer signifikanten Verringerung der Sterblichkeit innerhalb von 28 bis 90 Tagen führen kann.
Empfehlung 2.1
Wir empfehlen die Bauchlagerung bei invasiv beatmeten Patienten mit ARDS und Einschränkung der arteriellen Oxygenierung (PaO2/FiO2 <150 mmHg) durchzuführen.
Empfehlungsgrad: stark, Evidenzgrad: 1
Leider existieren keine randomisierten Studien, die verschiedene Bauchlagerungsprotokolle vergleichen. Daher basiert die Empfehlung zur Dauer der Bauchlagerung nur auf einzelnen Studien und Metaanalysen. In diesen varriierte die Dauer der Bauchlage zwischen sieben und 18 Stunden, wobei eine Dauer von zwölf Stunden als Mindestanforderung für positive Auswirkungen auf das Überleben gilt. Jede zusätzliche Stunde Bauchlage hat einen positiven Effekt, und die in früheren Leitlinien empfohlene Dauer von 16 Stunden scheint optimal zu sein, obwohl die Studien eine längere Dauer bislang nicht spezifisch untersucht haben.
Die S3-Leitlinine behält daher die bisherigen Empfehlungen der Vorgängerversion im Wesentlichen bei und konkretisiert lediglich die Empfehlung zur Mindestdauer.
Empfehlung 2.3
Wir empfehlen, eine Bauchlagerung mindestens 12, vorzugsweise 16 Stunden lang durchzuführen.
Empfehlungsgrad: stark, Evidenzgrad: 1
Auch die weiteren Empfehlungen zur Bauchlagerung finden sich in ihrer Substanz gegenüber der S2e-Leitlinie bestätigt und sind lediglich in Details präzisiert.
Metaanalysen zeigten, dass die Bauchlagerung bei COVID-19-Patienten im Wachzustand zu einer geringeren Intubationshäufigkeit führt und daher gemäß der S3-Leitlinie zur stationären Therapie von Patienten mit COVID-19 zu empfehlen ist [7].
Empfehlung 2.13
Wir empfehlen, bei nichtinvasiv beatmeten Patienten mit COVID-19 und akut hypoxischem Lungenversagen Bauchlagerungen im Wachzustand („awake proning“) durchzuführen.
Empfehlungsgrad: stark, Evidenzgrad: 1
Für andere Ursachen des hypoxischen Lungenversagens fehlen ausreichende Daten. Eine Empfehlung für Patienten mit anderen Ursachen des hypoxischen Lungenversagens wird aufgrund fehlender Daten daher nicht gegeben.
(Früh-)Mobilisation erhält größeres Gewicht
Die überarbeitete Leitlinie legt ein besonderes Augenmerk auf die Themen Mobilisation und Frühmobilisation.
In den ersten 48 Stunden nach einer Intensivstationseinweisung sind oft die schwersten Symptome einer Erkrankung zu beobachten. Elektrophysiologische Veränderungen treten auf, die für eine kritische Erkrankung der Muskeln typisch sind. Ab dem fünften Tag wird das muskelabbauende System aktiviert und das muskelaufbauende System herunterreguliert. Bereits am siebten Tag haben Patienten 12,5 Prozent ihrer Muskelmasse verloren. Mobilisation ist bisher die einzige Behandlung, die diese pathophysiologischen Veränderungen des neuromuskulären Systems verhindern kann [8, 9, 10].
Eine Metaanalyse untersuchte den besten Zeitpunkt für den Beginn der Mobilisation: Das geringste Risiko für eine auf der Intensivstation erworbene Schwäche war zu verzeichnen, wenn die Mobilisation zwischen 72 und 96 Stunden nach Beginn der Beatmung begann [11]. Ein früherer oder späterer Beginn hatte einen ungünstigen Einfluss auf die Beatmungsdauer. Der Beginn der Mobilisation wiederum wirkte sich nicht auf die Dauer des Aufenthalts auf der Intensivstation aus.
Frühzeitige Mobilisation hat positive Auswirkungen auf das Behandlungsergebnis, wie funktionelle Unabhängigkeit, Mobilität, Intensivstations- und Krankenhausverweildauer sowie delirfreie Tage und Entlassung nach Hause. Randomisierte kontrollierte Studien zeigten, dass der Beginn der Mobilisation innerhalb von 72 Stunden am effektivsten ist.
Empfehlung 3.1
Wir empfehlen, die Mobilisation von Intensivpatienten innerhalb von 72 Stunden nach Aufnahme zu starten.
Empfehlungsgrad: stark, Evidenzgrad: 1
Es gibt jedoch keine einheitliche Definition für den Begriff Frühmobilisation. Die PADIS-Leitlinie der Society of Critical Care Medicine, der US-amerikanischen Gesellschaft für Intensivmedizin, zu Pain, Agitation/Sedation, Delirium, Immobility and Sleep (PADIS, auf Deutsch: Schmerzen, Sedierung, Delirium, Immobilität und Schlafstörungen) empfiehlt einen stabilen kardiovaskulären, respiratorischen und neurologischen Zustand vor Beginn der Mobilisation, aber es gibt keine Primärdaten zu dieser Empfehlung [12].
Die Definition von Frühmobilisation bleibt in der S3-Leitlinie unverändert zur Definition in der S2e-Leitlinie, erhält nun jedoch eine starke Empfehlung. Dank einer deutlich verbesserten Studienlage enthält die überarbeitete Leitlinie nun eine Reihe differenzierter, konkretisierter und eindeutiger neuer Empfehlungen zur (Früh-)Mobilisation.
Eine internationale Befragung hat gezeigt, dass auf den Intensivstationen, die ein Mobilisationsprotokoll etabliert haben und regelmäßig (Früh-)Mobilisation anwenden, trotzdem Barrieren existieren. 70 Prozent der Studien haben ergeben, dass strukturelle Barrieren eine Frühmobilisierung beeinträchtigen oder verhindern [13, 14]. Um diese möglichen Barrieren abzubauen, enthält die S3-Leitlinie eine klare Empfehlung.
Empfehlung 3.2
Wir empfehlen, dass der Krankenhausträger die personellen und materiellen Voraussetzungen schafft, um (Früh-)Mobilisation entsprechend diesen Empfehlungen durchführbar zu machen.
Empfehlungsgrad: stark, Evidenzgrad: 5
Weiterhin wird darauf verwiesen, dass beatmete Patienten von Frühmobilisierung vielfältig profitieren. Daraus folgen konkrete Empfehlungen, die die vorherige funktionelle Situation der Patienten fokussieren.
CRRT und ECMO keine Kontraindikation
Zu möglichen therapiebedingten Barrieren haben die Leitlinienautoren ebenfalls differenzierte Empfehlungen formuliert, zum Beispiel zu extrakorporalen Verfahren und speziellen Krankheitsbildern, die wiederum eine Barriere für die Frühmobilisierung darstellen können.
CRRT. Die Sorge um Dislokation intravaskulärer Katheter unter einer kontinuierlichen Nierenersatztherapie (CRRT) ist eine häufige Barriere für die regelhafte Anwendung der (Früh-)Mobilisation. Studien haben 1,8 Prozent unerwünschte Ereignisse beschrieben, von denen 0,24 Prozent im Sinne einer Diskonnektion des Katheters für die CRRT oder einer katecholaminpflichtigen Hypotension schwerwiegend waren [15]. Insgesamt kann eine (Früh-)Mobilisation unter kontinuierlicher Ersatztherapie als sicher angesehen werden und eine kontinuierliche Nierenersatztherapie stellt damit keine Kontraindikation dar.
Empfehlung 3.5
Wir empfehlen, auch Patienten mit kontinuierlicher Nierenersatztherapie (CRRT) zu mobilisieren.
Empfehlungsgrad: stark, Evidenzgrad: 2
ECMO. Die extrakorporale Membranoxygenierungs-(ECMO-)Therapie ist an dieser Stelle explizit zu erwähnen, zumal die Leitlinienautoren eine entsprechende Empfehlung hervorgehoben haben. Sie wird nur bei schwer kranken Patienten angewendet. Dadurch entstehen häufig Barrieren für eine Mobilisation.
Eine Studie wies jedoch nach, dass bei 37 Prozent der Patienten eine Mobilisation bis zu einem bestimmten Aktivitätslevel möglich war. Dabei traten zwar unerwünschte Ereignisse auf. Diese ließen sich aber beheben [16].
Eine randomisierte Studie aus dem Jahr 2020 ergab keine Unterschiede in den respiratorischen oder hämodynamischen Parametern, aber Patienten in der Interventionsgruppe konnten früher mobilisiert werden [17]. Eine Observationsstudie zeigte ähnliche Ergebnisse [18]. ECMO-Therapie und (Früh-)Mobilisation sollten jedoch nur in spezialisierten Zentren erfolgen.
Empfehlung 3.7
Wir empfehlen, auch unter ECMO-Therapie (Früh-)Mobilisation durchzuführen.
Empfehlungsgrad: stark, Evidenzgrad: 3
Meilenstein: Immobilisation explizit anordnen
Eine Immobilisation kann sowohl für gesunde als auch kranke Menschen negative Auswirkungen haben, wie Muskelatrophie, Verlust von Muskelkraft und neuromuskulärer Funktion sowie Insulinresistenz. Daher ist es wichtig, die (Früh-)Mobilisation als Teil der Behandlung wahrzunehmen.
Fachpflegende sowie Physiotherapeutinnen und -therapeuten sollten die Mobilisierungsmaßnahmen anhand von Protokollen mit definierten Kriterien eigenständig nach einer individuellen Nutzen-Risiko-Abwägung einleiten und koordinieren. Patienten mit ausreichender respiratorischer und kardiovaskulärer Reserve sollten mobilisiert werden. Während der Mobilisationseinheit sind die kritisch erkrankten Personen engmaschig zu überwachen.
Die Umsetzung der (Früh-)Mobilisation auf Intensivstationen entspricht oft nicht dem empfohlenen Standard. Eine erfolgreiche Implementierung bedarf der interprofessionellen Zusammenarbeit und Abstimmung, zum Beispiel mithilfe eines Mobilisationsprotokolls [19, 20]. Die Empfehlung, eine medizinisch notwendige Immobilisation explizit anzuordnen, ist eine wichtige Neuerung der aktuellen Leitlinie und stellt einen bereits seit längerer Zeit überfälligen Paradigmenwechsel dar.
Empfehlung 3.8
Wir empfehlen, eine medizinisch notwendige Immobilisation explizit anzuordnen.
Empfehlungsgrad: stark, Evidenzgrad: 5
Im Umkehrschluss stellt sich die Frage, welche Patienten keine Frühmobilisation erhalten sollen. Daher haben die S3-Leitlinienautoren auch hier differenzierte und gegenüber der S2e-Leitlinie weiterentwickelte Empfehlungen zur Sicherheit, zu Abbruchkriterien und zur sicheren Durchführung formuliert und mit Vorschlägen zu Sicherheitskriterien und Praxistools für die Frühmobilisation ergänzt.
Zu Dauer, Häufigkeit und Intensität der Frühmobilisation enthält die Leitlinie weitere differenzierte Empfehlungen. Die Studienlage zur Dauer ist dabei indifferent, sodass die Leitlinienautoren eine patientenadaptierte Vorgehensweise empfehlen. Bezüglich der Intensität plädieren die Autoren für eine Orientierung an der ICU Mobility Scale (IMS), eine elfstufige Skala von 0 = keine Mobilisierung bis 10 = unabhängiges Gehen für die Planung, Dokumentation und Evaluation der Mobilisation von Intensivpatienten [21, 22, 23] (Tab.).
In vorliegenden Studien waren synergistische Effekte zwischen verschiedenen Behandlungssäulen der Therapie auf einer Intensivstation erkennbar.
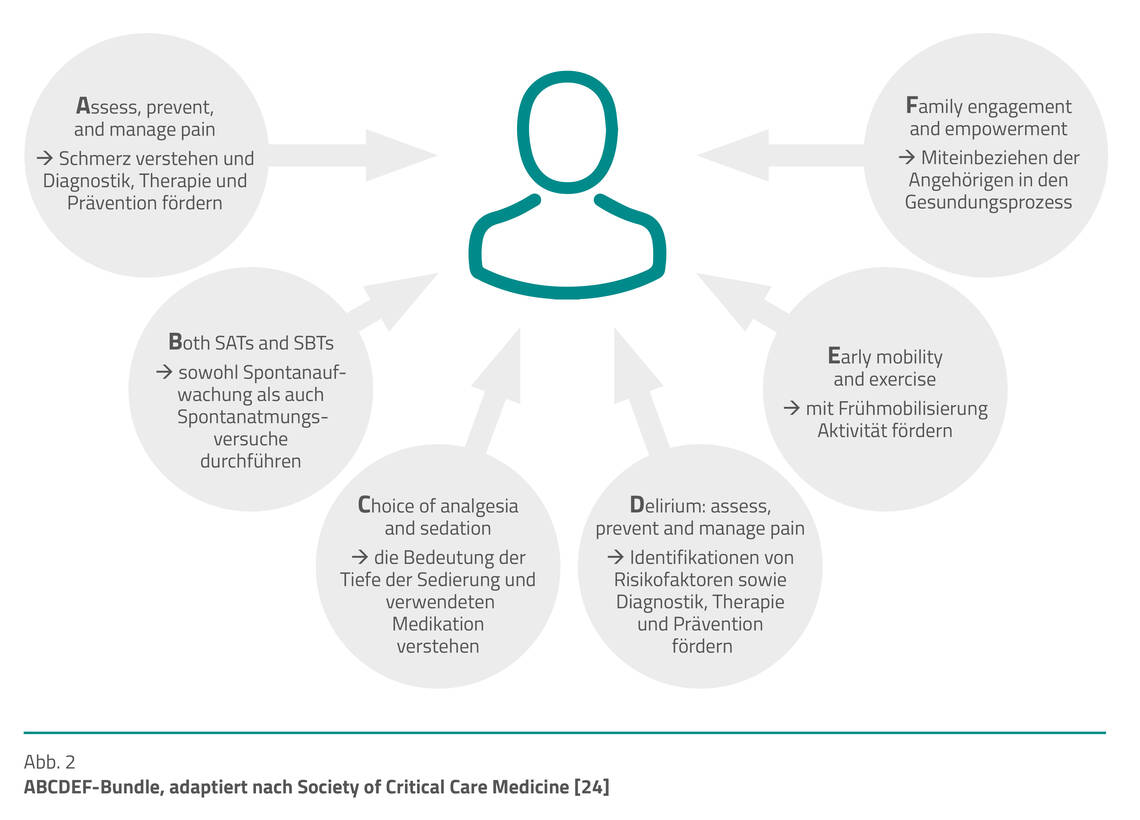
Entsprechend dieser Erkenntnisse sowie Empfehlungen für die einzelnen Aspekte in anderen Leitlinien empfiehlt sich ein abgestimmtes Vorgehen entsprechend eines Bundles. Dafür eignet sich zum Beispiel das ABCDEF-Bundle, ein evidenzbasierter Leitfaden zur Förderung der Beurteilung, Prävention und integrierten Behandlung von Intensivpatienten, adaptiert nach Society of Critical Care Medicine (Abb. 2) [24].
Insgesamt geben die Leitlinienautoren der Frühmobilisation deutlich mehr Raum und sehr differenzierte Empfehlungen. Damit wird die Leitlinie der großen und weiter wachsenden Bedeutung der Frühmobilisation sowie der sich ständig verbessernden Evidenz gerecht.
Hilfsmittel und NMES neu aufgenommen
In einem neu aufgenommenen Kapitel beschäftigt sich die S3-Leitlinie mit dem Einsatz von Hilfsmitteln auf der Intensivstation zur Mobilisation von Patienten. Diese Hilfsmittel umfassen das Bettfahrrad, das Laufband und die Robotik. Ziel ist, Muskelabbau zu vermeiden und die Behandlungsergebnisse kritisch kranker Patienten zu verbessern.
Die Anwendung und Einstellung der Hilfsmittel müssen geschult und die Hinweise des Herstellers beachtet werden. Die Bewertung der Studien zu den Auswirkungen von Hilfsmitteln ist schwierig, da die Studienprotokolle und Endpunkte sehr unterschiedlich und die Hilfsmittel oft Teil multimodaler Rehabilitationskonzepte sind. Die Endpunkte um- fassen Funktionalität, Muskelkraft, Beatmungsdauer sowie Krankenhaus- und Intensivstationsverweil- dauer.
Zusammengefasst wurde festgehalten, dass
- funktionelles Training einem Bettfahrrad vorzuziehen ist und
- die Datenlage für anderweitige Hilfsmittel oder Robotik aktuell unzureichend für eine Empfehlung ist.
Die neuromuskuläre Elektrostimulation (NMES) ist eine nichtinvasive Therapie, die anhand einer elektrischen Stimulation eine Muskelkontraktion auslöst. Sie kann bei Patienten zur Anwendung kommen, die aufgrund von Sedierung nicht aktiv mobilisierbar sind. Eine längere Mobilisierungsdauer und ein höherer Mobilisierungsgrad haben sich als vorteilhaft für das Behandlungsergebnis erwiesen.
Ob NMES für die Frühmobilisation von Intensivpatienten eingesetzt werden sollte, ist umstritten. Einige Studien zeigten keine signifikanten Unterschiede in Muskelkraft und anderen Outcomes zwischen NMES-Interventionsgruppe und Kontrollgruppe [25]. Andere Studien hingegen belegten eine Reduktion des Muskelmassenverlusts und der Muskelatrophie infolge NMES [26]. Mehr Forschung ist nötig.
Mehr Praxisbezug
Lagerungstherapie und Mobilisation kritisch kranker Patienten auf Intensivstationen sind elementare Bestandteile der interdisziplinären Behandlung. Die Überarbeitung der Empfehlungen in der neuen S3-Leitlinie Lagerungstherapie und Mobilisation von kritisch Erkrankten auf Intensivstationen soll eine hohe Qualität und Sicherheit der Therapie gewährleisten und positive Auswirkungen auf verschiedene Endpunkte wie Mortalität, Funktionalität und Lebensqualität haben.
Die Frühmobilisation erhält einen noch größeren Stellenwert. Sie sollte innerhalb von 72 Stunden nach Aufnahme beginnen und hat positive Auswirkungen auf das Behandlungsergebnis. Die ECMO-Therapie darf kein Hindernis für die Frühmobilisation darstellen. Eine konsequente Umsetzung der Empfehlungen kann dazu beitragen, dass die Therapie in Zukunft noch sicherer und effektiver erfolgen kann. Die neue S3-Leitlinie ist praktikabler als die vorherige S2e- Leitlinie und legt praktisch relevante Fragestellungen deutlicher dar.
DGIIN-Curriculum zur Frühmobilisierung
Die Deutsche Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN) hat in Zusammenarbeit mit dem Netzwerk Frühmobilisierung ein Curriculum für die Frühmobilisierung auf Intensivstationen, IMC-Stationen und in Notaufnahmen entwickelt, um die Bedeutung dieses Behandlungskonzepts darzustellen, ihre Durchführung zu vermitteln und die interprofessionelle Zusammenarbeit zu fördern. Das Curriculum ist als flexibles Baukastensystem konzipiert und bietet eine Strukturgrundlage für eine Fortbildung von Pflegepersonal, Ärztinnen und Ärzten, Physiothe- rapeutinnen und Physiotherapeuten, Psychologinnen und Psychologen sowie weiteren Mitgliedern der therapeutischen Teams an. Ziel des Curriculums ist, den Teilnehmenden das notwendige Wissen und entsprechende Fertigkeiten zu vermitteln. Die Absolventinnen und Absolventen werden be- fähigt, mit dem Wissen als Multiplikatoren für die Umsetzung der Konzepte für Frühmobilisierung in ihrer Einrichtung zu fungieren.
Nähere Informationen in Kürze unter dgiin.de
[1] Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI). S2e-Leitlinie Lagerungstherapie und Frühmobilisation zur Prophylaxe oder Therapie von pulmonalen Funktionsstörungen. Im Internet: register.awmf.org/assets/guidelines/001-015l_S2e_Lagerungstherapie_Fruehmobilisation_pulmonale_Funktionsstoerungen_2015-05- abgelaufen.pdf
[2] Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI). S3-Leitlinie Lagerungstherapie und Mobilisation von kritisch Erkrankten auf Intensivstationen. Im Internet: register.awmf.org/assets/guidelines/001-015l_S3_Lagerungstherapie-Mobilisation-von-kritisch- Erkrankten-auf-Intensivstationen_2023-07.pdf
[3] Li Bassi G, Panigada M, Ranzani OT et al. Randomized, multicenter trial of lateral Trendelenburg versus semirecumbent body position for the prevention of ventilator-associated pneumonia. Intensive Care Med. 2017; 43 (11): 1572–1584
[4] Schieren M, Wappler F, Klodt D et al. Continuous lateral rotational therapy in thoracic trauma – A matched pair analysis. Injury 2020; 51 (1): 51–58
[5] Wutzler S, Sturm K, Lustenberger T et al. Kinetic therapy in multiple trauma patients with severe thoracic trauma: a treatment option to reduce ventilator time and improve outcome. Eur J Trauma Emerg Surg 2017; 43 (2): 155–161
[6] Guerin C, Reignier J, Richard JC et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368 (23): 2159–2168
[7] Li J, Luo J, Pavlov I et al. Awake prone positioning for non-intubated patients with COVID-19-related acute hypoxaemic respiratory failure: a systematic review and meta-analysis. Lancet Respir Med 2022; 10 (6): 573–583
[8] Friedrich O, Reid MB, Van den Berghe G et al. The Sick and the Weak: Neuropathies/Myopathies in the Critically Ill. Physiol Rev. 2015; 95 (3): 1025–1109
[9] Puthucheary ZA, Rawal J, McPhail M et al. Acute skeletal muscle wasting in critical illness. JAMA 2013; 310 (15): 1591–1600
[10] Fazzini B, Markl T, Costas C et al. The rate and assessment of muscle wasting during critical illness: a systematic review and meta-analysis. Crit Care 2023; 27 (1): 2
[11] Ding N, Zhang Z, Zhang C et al. What is the optimum time for initiation of early mobilization in mechanically ventilated patients? A network meta-analysis. PLoS One 2019; 14 (10): e0223151
[12] Devlin JW, Skrobik Y, Gelinas C et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med 2018; 46 (9): e825–e873
[13] Dubb R, Nydahl P, Hermes C et al. Barriers and Strategies for Early Mobilization of Patients in Intensive Care Units. Ann Am Thorac Soc 2016; 13 (5): 724–730
[14] Nydahl P, Gunther U, Diers A et al. PROtocol-based MObilizaTION on intensive care units: stepped-wedge, cluster-randomized pilot study (Pro-Motion). Nurs Crit Care 2020; 25 (6): 368–375
[15] Mayer KP, Joseph-Isang E, Robinson LE et al. Safety and Feasibility of Physical Rehabilitation and Active Mobilization in Patients Requiring Continuous Renal Replacement Therapy: A Systematic Review. Crit Care Med 2020; 48 (11): e1112–e1120
[16] Braune S, Bojes P, Mecklenburg A et al. Feasibility, safety, and resource utilisation of active mobilisation of patients on extracorporeal life support: a prospective observational study. Ann Intensive Care 2020; 10 (1): 161
[17] Hayes K, Holland AE, Pellegrino VA et al. Early rehabilitation during extracorporeal membrane oxygenation has minimal impact on physiolo- gical parameters: A pilot randomised controlled trial. Aust Crit Care 2021; 34 (3): 217–225
[18] Liu K, Ogura T, Takahashi K et al. The safety of a novel early mobilization protocol conducted by ICU physicians: a prospective observational study. J Intensive Care 2018; 6: 10
[19] Nydahl P, Ruhl AP, Bartoszek G et al. Early mobilization of mechanically ventilated patients: a 1-day point-prevalence study in Germany. Crit Care Med 2014; 42 (5): 1178–1186
[20] Hermes C, Ochmann T, Keienburg C et al. Intensive care of patients with [infarct-related] cardiogenic shock : Abridged version of the S1 guideline. Med Klin Intensivmed Notfmed 2022; 117 (Suppl 2): 25–36
[21] Hodgson CL, Bailey M, Bellomo R et al. A Binational Multicenter Pilot Feasibility Randomized Controlled Trial of Early Goal-Directed Mobilization in the ICU. Crit Care Med 2016; 44 (6): 1145–1152
[22] Hodgson C, Needham D, Haines K et al. Feasibility and inter-rater reliability of the ICU Mobility Scale. Heart Lung 2014; 43 (1): 19–24
[23] Tipping CJ, Bailey MJ, Bellomo R et al. The ICU Mobility Scale Has Construct and Predictive Validity and Is Responsive. A Multicenter Observational Study. Ann Am Thorac Soc 2016; 13 (6): 887–893
[24] SCCM. ICU Liberation Bundle (A-F). Im Internet: www.sccm.org/Clinical-Resources/ICULiberation-Home/ABCDEF-Bundles (accessed: 19.01.2023)
[25] Fossat G, Baudin F, Courtes L et al. Effect of In-Bed Leg Cycling and Electrical Stimulation of the Quadriceps on Global Muscle Strength in Critically Ill Adults: A Randomized Clinical Trial. JAMA 2018; 320 (4): 368–378
[26] Gerovasili V, Stefanidis K, Vitzilaios K et al. Electrical muscle stimulation preserves the muscle mass of critically ill patients: a randomized study. Crit Care 2009; 13 (5): R161